
【题目】下表是元素周期表的一部分,回答下列问题:
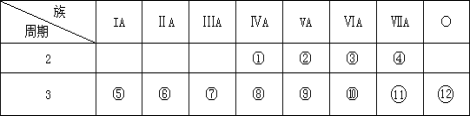
(1)在这些元素中,_____(用元素符号填写,下同)是最活泼的金属元素;_____是最活泼的非金属元素,它们组成的化合物含有的化学键类型为_____。
(2)这些元素的最高价氧化物的对应水化物中_____酸性最强;_____碱性最强;能形成两性氢氧化物的元素是_____。
(3)写出①的最高价氧化物的化学式_____,电子式_____。
(4)③和氢元素组成的化合物中,既含有极性共价键又含有非极性共价键的化合物是_____。
(5)比较⑤与⑥的化学性质,_____更活泼,试用实验证明此现象_____(简述操作、现象和结论)。
【答案】Na F 离子键 HClO4 NaOH Al CO2 ![]() H2O2 Na 金属钠和金属镁的单质分别与冷水反应,钠与冷水剧烈反应,镁与冷水反应很微弱
H2O2 Na 金属钠和金属镁的单质分别与冷水反应,钠与冷水剧烈反应,镁与冷水反应很微弱
【解析】
(1)周期表中,从上到下金属的活泼性逐渐增强,从右到左金属活泼性逐渐增强;稀有气体化学性质稳定;
(2)周期表中,从上到下元素的最高价氧化物对应水化物的碱性逐渐增强,从左到右元素的最高价氧化物对应水化物的酸性逐渐增强;氢氧化铝显两性;
(3)①为碳元素,最高价氧化物为二氧化碳;
(4)③为氧元素,与氢元素组成的化合物中,既含有极性共价键又含有非极性共价键的是过氧化氢;
(5)同周期自左而右金属性减弱,可以利用金属与水的反应进行验证。
(1)根据元素周期表性质的递变规律,最活泼的金属应在第IA,最活泼的非金属应在第VIIA,惰性气体最不活泼,则在IA元素Na最活泼;在VII元素④F最活泼;它们组成的化合物NaF为离子化合物,含有的化学键类型为离子键;
(2)元素的最高价氧化物对应水化物中,酸性最强的必是非金属性最强的,根据同周期、同主族元素非金属性的递变规律可知,元素非金属性最强的是②即F,但F无最高正价。因为我们知道,HClO4是已知的最高价含氧酸中酸性最强的,即酸性最强的是HClO4,元素的最高价氧化物对应水化物中,碱性最强的必是非金属性最强的,根据同周期、同主族元素金属性的递变规律可知,元素金属性最强的是⑤即Na,则碱性最强的必是NaOH,在表中所列元素的最高价氧化物对应水化物中,只有Al(OH)3具有两性,能形成两性氢氧化物的元素是Al元素;
(3)①为碳元素,最高价氧化物为二氧化碳,其化学式为CO2,电子式为![]() ;
;
(4)③为氧元素,与氢元素组成的化合物中,既含有极性共价键又含有非极性共价键的是过氧化氢,化学式为H2O2;
(5)⑤和⑥分别是Na和Mg,根据同主族元素金属性的递变规律可知,金属性Na>Mg,根据判断金属性强弱的方法,可依据二者单质分别与水反应的剧烈程度来判断其金属性强弱,即与H2O反应,故答案为:Na;金属钠和金属镁的单质分别与冷水反应,钠与冷水剧烈反应,镁与冷水反应很微弱。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】除去粗盐中的杂质 CaCl2、MgCl2 和 Na2SO4,过程如下:
![]()
下列有关说法中,不正确的是( )
A. 除去 Mg2+的主要反应: Mg2++ 2OH-=Mg(OH)2↓
B. 试剂①一定不是Na2CO3溶液
C. 检验 SO42-是否除净:取少量滤液,加稀盐酸酸化,再加 BaCl2 溶液
D. 滤液加稀盐酸时只发生反应:H+ +OH- =H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直链形的不饱和油酸(C17H33COOH)与蔗糖反应可以制得非天然油脂,其反应示意图如图所示(注:图中反应式不完整)。
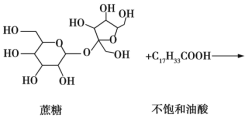
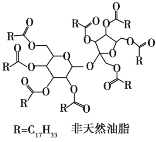
下列说法中不正确的是
A.甘油和蔗糖都可以在一定条件下发生消去反应
B.天然油脂、蔗糖、非天然油脂都能发生水解反应
C.该非天然油脂与氢氧化钠溶液共热,可以发生皂化反应,水解后的产物可与溴的四氯化碳溶液反应
D.蔗糖分子结构中不含醛基,是非还原性糖,不能直接与银氨溶液发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,改变0.1mol·L-1H2SO3溶液的pH,各微粒的物质的量分数(α)变化如图所示,下列说法中错误的是
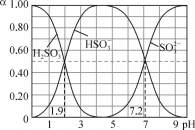
A. 1gK1(H2SO3)=-1.9
B. pH=3时,c(HSO3-)>c(H2SO3)>c(SO32-)
C. 反应H2SO3+SO32-![]() 2HSO3-的lgK=5.3
2HSO3-的lgK=5.3
D. pH=7.2时,c(HSO3-)=c(SO32-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似pH,是指稀溶液中溶质物质的量浓度的负对数。如某溶液溶质的浓度为1×10-3mol/L,则该溶液中溶质的pC=3。下列叙述正确的是
A.某温度下,任何电解质的稀溶液中,pC(H+)![]() pC(OH-)
pC(OH-)![]()
B.0.01mol/L的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pC(Ca2+)逐渐增大
C.0.01mol/L的BaCl2溶液中,pC(Cl-)![]() 2pC(Ba2+)
2pC(Ba2+)
D.用0.01mol/L的盐酸滴定某浓度的NaOH溶液,NaOH溶液的pC(OH-)逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠用作媒染剂,纺织品的防火剂、增重剂,以及制造陶瓷、玻璃和用于镀锡等。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠(Na2SnO3)的工艺流程图如下:
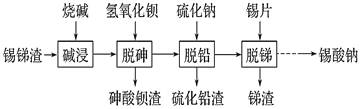
请回答下列问题:
(1) Sb(ⅤA)最高正化合价为_____。
(2) 流程中“脱砷、脱铅、脱锑”均要涉及的分离实验操作是_________。
(3)“碱浸”时,若SnO含量较高,工业上则加入NaNO3除去SnO,且检测到有NH3生成。
①该反应的离子方程式为____________________;
②如图是“碱浸”实验的参数,请选择“碱浸”的合适条件__________。

(4) “脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为________。
(5) “脱锑”时发生的主要化学反应属于_________。
A.置换反应 B.氧化还原反应 C.非氧化还原反应
(6) 硫酸盐光亮镀锡液成分简单,主要有硫酸亚锡、硫酸等成分。镀锡液中硫酸的作用是__________;镀锡时阳极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是(NA为阿伏加德罗常数的值)
A. O2-的电子式为![]() ,则O2-核外有8个电子
,则O2-核外有8个电子
B. 1mol NH4Cl中含有的H-Cl键的数目为NA
C. CrO5中Cr元素的化合价为+6价,每个CrO5分子中存在两个过氧键
D. 20gNa2O和Na2O2的混合物中,所含阴阳离子数目之比无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生探究0.25mol/LAl2(SO4)3溶液与 0.5mol/LNa2CO3溶液的反应,实验如下。
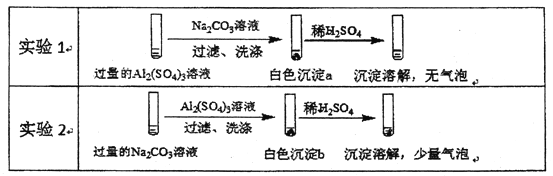
下列分析不正确的是
A. 实验1中,白色沉淀a是A1(OH)3
B. 实验2中,白色沉淀b含有CO32-
C. 实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH有关
D. 检验白色沉淀a、b是否洗涤干净,不可使用相同的检验试剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图1是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,则E1________(填“增大”、“减小”或“不变”,下同),ΔH________。请写出NO2和CO反应的热化学方程式:________________。
(2)观察图a和图b,根据盖斯定律,写出△H1、△H2、△H3、△H4、△H5和△H6的关系。图a:________________________;图b:_________________________。
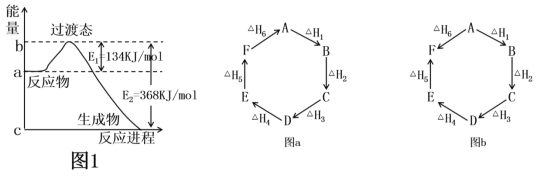
(3)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:① H2O(l)=H2O(g) △H=+44 kJ/mol
② 2N2(g)+CO2(g)+2H2O(g)=CH4(g)+4NO(g) △H= +1160 kJ/mol
③ CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= -574 kJ/mol
请写出CH4(g)与NO2(g)反应生成参与大气循环的气体和液态水的热化学方程式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com