
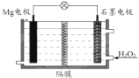
 Mg-H2O2电池可用于驱动无人驾驶的潜航器,该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器,该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )| A、Mg电极是该电池的正极 |
| B、H2O2在石墨电极上发生氧化反应 |
| C、电子由Mg电极经过外电路流向石墨电极 |
| D、溶液中Cl-向正极移动 |


科目:高中化学 来源: 题型:
| A、用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O |
| B、往碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O |
| C、往氨水中滴加氯化铝溶液:Al3++4OH-═AlO2-+2H2O |
| D、氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,pH=7的溶液中:Al3+、K+、SO42-、HCO3- |
| B、常温下,c(OH-)=1×10-13mol/L的溶液中:K+、SO42-、Cl-、CO32- |
| C、能使pH试纸变深蓝色的溶液中:S2-、SO32-、Na+、SO42- |
| D、常温下,由水电离出的c(OH-)=1×10-13mol/L的溶液中:Fe2+、NH4+、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、①④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温常压下,16g O2和O3的混合气体所含原子数目为NA |
| B、1mol/L K2SO4溶液所含K+数目为2NA |
| C、在标准状况下,22.4L水所含分子数目为NA |
| D、7.8g Na2O2与CO2完全反应时,转移电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Ba2+、NO3-、SO42- |
| B、K+、Na+、CO32-、NO3- |
| C、K+、NH4+、MnO4-、Cl- |
| D、Mg2+、Al3+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
139 57 |
59 28 |
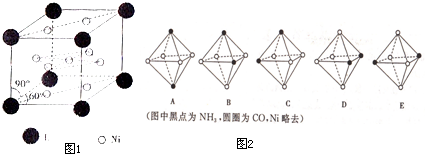
查看答案和解析>>
科目:高中化学 来源: 题型:
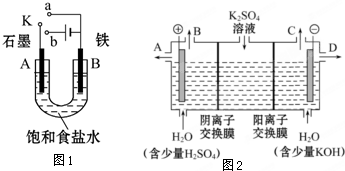 某课外活动小组用如图1装置进行实验,试回答下列问题.
某课外活动小组用如图1装置进行实验,试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
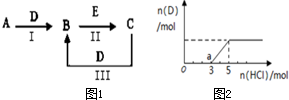 A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图1所示.
A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图1所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com