
| A、若混合后溶液中c(Na+)>c(X-),说明HX的电离程度弱于X-的水解程度 |
| B、若混合溶液呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) |
| C、混合溶液中c(HX)+c(X-)=0.2 mol?L-1 |
| D、混合溶液中c(Na+)+c(H+)=c(X-)+c(OH-) |


科目:高中化学 来源: 题型:
| A、石油裂解、煤的气化、海水制镁都包含化学变化来源 |
| B、福尔马林可制备标本是利用了使蛋白质变性的性质 |
| C、含钙、钡、铂等金属元素的物质有绚丽的颜色,可用于制造焰火 |
| D、红葡萄酒储藏时间长后变香可能是因为乙醇发生了酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该有机物的相对分子质量为28 |
| B、分子中C、H个数比为1:2 |
| C、分子中的C、H、O个数比为1:2:3 |
| D、该分子中肯定不含氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
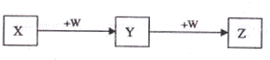
| A、若W是单质铁,则Z溶液可能是FeCl2溶液 |
| B、若W是氢氧化钠,则X水溶液呈酸性 |
| C、若W是氧气,则X、Z的相对分子质量可能相差48 |
| D、若W是强氧化性的单质,则X可能是金属铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯使溴水或酸性高锰酸钾褪色均属于加成反应 |
| B、用乙醇与浓硫酸加热至170℃制乙烯的反应属于取代反应 |
| C、用重铬酸钾溶液检验司机是否酒驾所发生的反应属于乙醇的氧化反应 |
| D、用“地沟油”生产生物柴油只发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用惰性电极电解一定量的硫酸铜溶液,电解过程中的实验数据如图所示.横坐标表示转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).下列判断正确的是( )
用惰性电极电解一定量的硫酸铜溶液,电解过程中的实验数据如图所示.横坐标表示转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).下列判断正确的是( )| A、电解过程中,溶液的pH不断增大 |
| B、当转移0.4mol e-时,电解生成的铜为6.4g |
| C、阳极电极反应式为2H2O+4e-=4H++O2↑ |
| D、Q点对应的气体中,H2与O2的体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2NaCl(水溶液)
| ||
B、CuO+H2
| ||
C、Fe3O4+4CO
| ||
D、2HgO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C(s)+O2(g)═CO(g)△H=-110.5 kJ/mol | ||
| B、C(s)+O2(g)═CO2(g)△H=-393.5 kJ/mol | ||
| C、2H2 (g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | ||
D、H2(g)+
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com