
| A. | 乙酸的结构简式 C2H4O2 | B. | 氯化钠的电子式: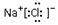 | ||
| C. | 硫原子的原子结构示意图: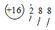 | D. | 水的电离方程式 2H2O═H3O++OH- |
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | 通入过量的NH3(g):Ag+、NH4+、NO3-、OH- | |
| B. | 加入过量 HNO3(aq):NH4+、Ag+、H+、NO3- | |
| C. | 通入过量 HCl(g):NH4+、H+、Cl-、NO3- | |
| D. | 加入过量NaOH(aq):NH4+、Na+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 应用 |
| A | Na2O2与水、CO2反应 | 潜水艇O2的来源 |
| B | 单质镁有强还原性 | 镁合金作飞机材料 |
| C | 次氯酸及其盐具有漂白性 | 净化饮用水 |
| D | 铜不与O2反应 | 制备铜币 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
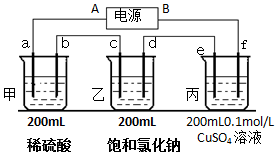 用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电后,a极产生的气体明显多于b极,2分钟后,测得乙池的pH为12,则
用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电后,a极产生的气体明显多于b极,2分钟后,测得乙池的pH为12,则查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol O3与11.2 L O2所含的分子数一定相等 | |
| B. | 标准状况下,11.2 L由N2与CO组成的混合气体含有的原子数目为NA | |
| C. | 标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA | |
| D. | 常温常压下,22.4 L的NO2和CO2混合气体含有2NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1L 0.1mol/L的Na2CO3溶液中,阴离子总数小于0.1NA | |
| B. | 常温常压下,17 g甲基(-14CH3)所含的电子数为9NA | |
| C. | 标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA | |
| D. | 将1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ),同时利用此装置的电能在铁上镀铜,下列说法正确的是( )
),同时利用此装置的电能在铁上镀铜,下列说法正确的是( )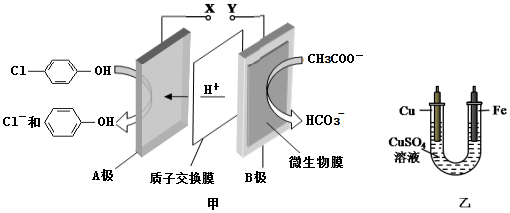
| A. | 当外电路中有0.2 mole-转移时,A极区增加的H+的个数为0.1 NA | |
| B. | A极的电极反应式为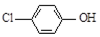 +e-=Cl-+ +e-=Cl-+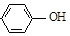 | |
| C. | 铁电极应与Y相连接 | |
| D. | 反应过程中甲中右边区域溶液pH逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的浓度可能为0.3mol/L | |
| B. | 平衡时X2、Y2的转化率相等 | |
| C. | 平衡时,Y2和Z的生成速率之比为2:1 | |
| D. | 若平衡后再改变外界条件,升高温度,则反应的平衡常数将变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com