
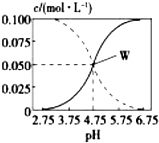
 25℃时,由醋酸和醋酸钠按一定比例混合形成的溶液始终保持c(CH3COOH)+c(CH3COO-)=0.1mol/L,该溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示,下列有关该溶液的叙述中正确的是( )
25℃时,由醋酸和醋酸钠按一定比例混合形成的溶液始终保持c(CH3COOH)+c(CH3COO-)=0.1mol/L,该溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示,下列有关该溶液的叙述中正确的是( )| A. | pH=5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | W点所表示的溶液中:c(Na+)=c(CH3COOH) | |
| C. | pH=3的溶液中:c(H+)+c(Na+)+c(CH3COOH)=0.1mol/L | |
| D. | 据图象可求得该温度下CH3COOH的电离常数Ka=10-4.75 |
分析 根据图象可看出,浓度增大的曲线应为c(CH3COO-),浓度减小的曲线应为c(CH3COOH),W点时c(CH3COOH)=c(CH3COO-),
A.根据图象结合溶液pH分析;
B.根据混合液中的电荷守恒计算判断;
C.结合溶液的电荷守恒、物料守恒判断;
D.根据醋酸的电离平衡常数表达式进行计算.
解答 解:A.根据图象知,pH=5的溶液中:c(CH3COOH)<c(CH3COO-),故A错误;
B.W点所表示的溶液中:c(CH3COOH)=c(CH3COO-)=0.05mol/L,溶液中c(Na+)+c(H+)=c(CH3COO-)+c(OH-),酸性溶液中c(H+)>c(OH-),
所以c(Na+)<c(CH3COOH),故B错误;
C.pH=3溶液中c(Na+)+c(H+)=c(CH3COO-)+c(OH-),再把题干中的c(CH3COOH)+c(CH3COO-)=0.1mol•L-1代入即可得c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol•L-1,故C错误;
D.W点时溶液的pH=4.75,此时c(CH3COOH)=c(CH3COO-),则醋酸的平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=10-4.75mol•L-1,故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确图象中曲线变化的含义为解答关键,注意掌握电荷守恒、物料守恒、质子守恒及盐的水解原理在判断离子浓度大小中的应用方法.


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 | |
| B. | 结构简式为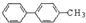 的烃,分子中含有两个苯环的该烃的同分异构体为4种 的烃,分子中含有两个苯环的该烃的同分异构体为4种 | |
| C. | 碳原子数小于或等于10的烷烃中其一氯代物只有一种的烷烃有4种 | |
| D. | 菲的结构简式为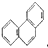 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验内容 | 实验观察 | 离子方程式 | 解释与结论 |
| ① | 在FeCl2溶液中 滴入适量氯水 | 溶液由浅绿色 变为黄色 | 2Fe2++Cl2═2Fe3++2Cl- | Fe2+具有还原性 |
② | 在FeCl2溶液中 加入锌片 | / | Zn+Fe2+=Zn2+ +Fe | Fe2+具有氧化性 |
| ③ | 在FeCl3溶液中 加入足量铁粉 | 溶液由黄色变成浅绿色 | Fe+2Fe3+═3Fe2+ | Fe3+具有氧化性 |
④ | 在FeCl3溶液中 通入H2S气体 | 溶液变为浅绿色并 有淡黄色沉淀生成 | H2S+2Fe3+=2Fe2++S↓+2H+ | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与少量乙二醛混合可制备乙二酸 | |
| B. | 与浓盐酸反应的离子方程式为:2MnO4-+16 H++10Cl-=5Cl2↑+2Mn2++8 H20 | |
| C. | 与K+、NO3-、SO42-、CO32-可以大量共存 | |
| D. | 与过量Na202混合后,共转移e-0.05mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E、F、G、W八种原子序数依次增大的元素(原子序数均小于30),A原子的核外电子数与电子层数相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,E、F同主族,G与W同周期同族且原子序数相差2.请回答下列问题:
有A、B、C、D、E、F、G、W八种原子序数依次增大的元素(原子序数均小于30),A原子的核外电子数与电子层数相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,E、F同主族,G与W同周期同族且原子序数相差2.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和高分子化合物PCL的合成路线如下:
和高分子化合物PCL的合成路线如下:
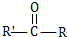 $\stackrel{过氧化物}{→}$
$\stackrel{过氧化物}{→}$ (R、R′代表烃基)
(R、R′代表烃基)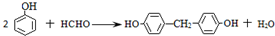 .
. .
.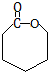 .高分子化合物PCL的结构简式是
.高分子化合物PCL的结构简式是 .
. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 对PM2.5、SO2、NOx等进行研究,有助于了解雾霾和减弱雾霾的影响.请回答下列问题:
对PM2.5、SO2、NOx等进行研究,有助于了解雾霾和减弱雾霾的影响.请回答下列问题:| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度(mol•L-1) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com