
��4mol A�����2mol B������2L�������л�ϲ���һ�������·������·�Ӧ��2A(g)+B(g)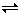 2C(g)������2s����C��Ũ��Ϊ0.6mol/L�����м���˵����
2C(g)������2s����C��Ũ��Ϊ0.6mol/L�����м���˵����
��������A��ʾ�ķ�Ӧ��ƽ������Ϊ0.3 mol/(L��s)
��������B��ʾ�ķ�Ӧ��ƽ������Ϊ0.6 mol/(L��s )
��2sʱ����A��ת����Ϊ70%
��2sʱB���ʵ�Ũ��Ϊ0.7 mol/L
������ȷ����( )
A���٢� B���٢� C���ڢ� D���ۢ�

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���㽭ʡ�����и߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ӦA+B��C����������: ��A+B��X, ��X��C, ��Ӧ�����������仯��ͼ��ʾ, E1��ʾ��ӦA+B��X�Ļ�ܡ������й���������ȷ���ǣ� ��
A����ӦA+B��X�ġ�H >0
B����ӦA+B��C�ġ�H = E1-E2
C��E2��ʾ��ӦC��X�Ļ��
D��X�Ƿ�ӦA+B��C���м����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���Ĵ�ʡ�߶��ϰ��ڿ��Ի�ѧ���������棩 ���ͣ�ѡ����
��������ʵ����ʵ�����ܵõ���Ӧ���۵��� �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���Ĵ�ʡ�߶��ϰ��ڿ��Ի�ѧ���������棩 ���ͣ�ѡ����
��֪ X2(g)+Y2 (g)  2Z(g)��X2��Y2��Z ����ʼŨ�ȷֱ�Ϊ 0.1mol��L��1��0.3mol��L��1��0.2mol��L��1����һ�������£�����Ӧ�ﵽƽ��ʱ�������ʵ�Ũ�ȿ����ǣ� ��
2Z(g)��X2��Y2��Z ����ʼŨ�ȷֱ�Ϊ 0.1mol��L��1��0.3mol��L��1��0.2mol��L��1����һ�������£�����Ӧ�ﵽƽ��ʱ�������ʵ�Ũ�ȿ����ǣ� ��
A��Z Ϊ 0.4 mol��L��1 B��X2 Ϊ 0.2 mol��L��1
C��Y2Ϊ 0.4 mol��L��1 D��Z Ϊ 0.3 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ�߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£���pH=1��������Һƽ���ֳ����ȷݣ�һ�ݼ�������ˮ����һ�ݼ������������Һ���ʵ���Ũ����ͬ������������Һ�����Ϻ���Һ������ڻ��ǰ��Һ�����֮�ͣ�������pH��������1�������ˮ�ͼ���NaOH��Һ�������ԼΪ( )
A��11��1 B��10��1 C��6��1 D��5��1
B��10��1 C��6��1 D��5��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ�߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
������ʵ��˵����������������ʵ��ǣ� ����
����������Һ�д���HNO2���ӣ�������
����HNO2��Һ��������ʵ�飬���ݺܰ�
��HNO2��Һ����Na2SO4��Һ��Ӧ
��0.1mol/L HNO2��Һ�У�c(H+)=0.015mol/L
����ͬŨ��ʱ��HNO2�� ����������HCl��
����������HCl��
A���٢ڢ� B���ڢۢ� C���٢ܢ� D���٢ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���Ĵ�ʡ�ɶ��и�����ѧ��һ�ﻯѧ�Ծ��������棩 ���ͣ������
[��ѧ����ѡ��3�����ʽṹ������]��֪��Ӧ
��1����̬Feԭ�Ӻ���� ���˶�״̬����ͬ�ĵ��ӣ�Fe3+�ļ۵����Ų�ͼΪ__________��
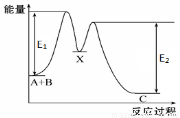
��2��NaH�ĵ���ʽΪ ��1mol NaOH���е�d����ĿΪ___________������Oԭ�ӵ��ӻ�����Ϊ ��Fe3+���Ժ�SCN-�γ������÷�Ӧ�ǵ��͵Ŀ��淴Ӧ��˵����λԭ����λ���� ���ǿ������������
��3��������Ӧ�к�Na�Ļ����ᄃ�����;�Ϊ ���壻NaH���۵���������NaOH����Ҫԭ���� ��
��4��ij�ֵ������ľ���Ϊ���������ѻ�������ԭ�ӵ���λ��Ϊ__________����r(Fe)��ʾFeԭ�ӵİ뾶����������ԭ�ӿռ�������Ϊ [�г���r(Fe)�ļ������ʽ��]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017������ʡ�����и�����ѧ��һ�컯ѧ�Ծ��������棩 ���ͣ�ѡ����
��������Ϊ����ͭ��֮�硱�������˴��۶���ë������ɢ���̵����������ͭ�����о���ͭ������Cu��Sn�ȣ��ڳ�ʪ�����з����ĸ�ʴ�������ﱣ����������Ҫ���塣��ͼΪ��ͭ���ڳ�ʪ�����з����绯ѧ��ʴ��ԭ��ʾ��ͼ������˵������ȷ����
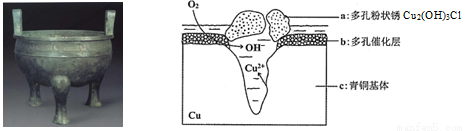
A. ��ͭ�������绯ѧ��ʴ��ͼ��c��������������
B. ���������ĵ缫��ӦΪO2+ 4e��+2H2O=4OH��
C. �����е�Cl�� ��������������Ӧ�IJ�����������a�����ӷ���ʽΪ2Cu2��+3OH��+Cl��=Cu2 (OH)3Cl��
D. ������0.2 mol Cu2(OH)3Cl�������������ĵ�O2���Ϊ4.48L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017������ʡ������Э��������������Ļ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����Ⱥ����ܱ�������ͨ��S O2��NO2��һ��������ʹ��ӦSO2(g)+NO2(g)
O2��NO2��һ��������ʹ��ӦSO2(g)+NO2(g) SO3(g)+NO(g)�ﵽƽ�⣬����Ӧ������ʱ��仯
SO3(g)+NO(g)�ﵽƽ�⣬����Ӧ������ʱ��仯 ��ʾ��ͼ������ʾ����ͼ�ɵó�����ȷ������( )
��ʾ��ͼ������ʾ����ͼ�ɵó�����ȷ������( )
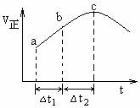
A.��Ӧ��c��ﵽƽ��״̬
B.��Ӧ��Ũ�ȣ�a��С��b��
C.��Ӧ��������������������������
D.��t1=��t2ʱ��SO2��ת���ʣ�a-b��С��b-c��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com