
����Ŀ��ʵ������ͼʾװ����ȡ����İ�����
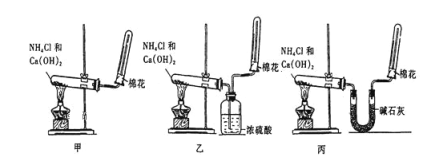
��1��ʵ�����Ʊ�������ѧ����ʽ��_______________________________��
��2����ҵ�Ʊ������Ļ�ѧ����ʽ��_____________________________________________��
��3�������Ƶø���İ�����Ӧѡ��װ��_______����ס����ҡ�����������������װ�ø��ﰱ����ԭ��_______________________________���û�ѧ����ʽ��ʾ����
��4�������Թ�C�а����ռ����ķ�����______________________��
��5���Թܿڷ�������������_________________________________________��
��6��ijͬѧ�������ͼװ���ռ�����������˵������ȷ����________(����ĸ)��
A���ռ�������ԭ���������ſ�����
B������ܵ������Ƿ�ֹ����
C�����ձ��е�ˮ���ʱ֤���������ռ���
D����װ�û��γɺ�ɫ��Ȫ
���𰸡�2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+H2O N2+3H2
CaCl2+2NH3��+H2O N2+3H2![]() 2NH3 �� 2NH3+H2SO4=(NH4)2SO4 ��ʪ��ĺ�ɫʯ����ֽ�����Թܿڣ�����ֽ��������˵�����ռ��������ò�����պȡŨ������Թܿڣ����а������ɣ���˵�����ռ����� ��ֹ�����백���������ռ����������İ��� D
2NH3 �� 2NH3+H2SO4=(NH4)2SO4 ��ʪ��ĺ�ɫʯ����ֽ�����Թܿڣ�����ֽ��������˵�����ռ��������ò�����պȡŨ������Թܿڣ����а������ɣ���˵�����ռ����� ��ֹ�����백���������ռ����������İ��� D
��������
��1��ʵ���������ù��������������Ȼ���Ʊ�������
��2����ҵ�����õ����������Ʊ�������
��3������Ϊ�������壬���������Ը�������
��4�����ݰ����Ǽ������壬����ʪ��ĺ�ɫʯ����ֽ������������պ��Ũ����IJ�������ð���̣������Ƿ�����
��5�������ܶȱȿ���С���ռ�����ʱ������������Χ����������,ʹ�ռ�װ�ò��ܼ�����
��6��A���������ܶ�С�ڿ����ܶȣ�
B���л������õ�װ���ܷ�ֹ������
C����ˮ��Һ�ʼ��ԣ�������̪��Һ���ɫ��
D��������л������ã������γ���Ȫ��
��1��ʵ��������NH4Cl��Ca��OH��2���ȿ��Ʊ���������Ӧ�Ļ�ѧ����ʽΪ��2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+H2O��
CaCl2+2NH3��+H2O��
�ʴ�Ϊ��2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+H2O��
CaCl2+2NH3��+H2O��
��2����ҵ�����õ����������ϳɰ����仯ѧ����ʽΪ��N2+3H2![]() 2NH3��
2NH3��
�ʴ�Ϊ��N2+3H2![]() 2NH3��
2NH3��
��3������Ϊ�������壬����ͼʾ��Ϣ����ѡ�����Ը��������ʯ�ң������������װ���ң���ΪŨ����Ϊ���Ը���������백��������ѧ��Ӧ��������泥��仯ѧ����ʽΪ��2NH3+H2SO4=(NH4)2SO4��
�ʴ�Ϊ������2NH3+H2SO4=(NH4)2SO4��
��4�������Ǽ������壬����ʪ��ĺ�ɫʯ����ֽ����֤��������պ��Ũ����IJ�������ð���̣��ʼ����Թ�C�а����ռ����ķ���Ϊ����ʪ��ĺ�ɫʯ����ֽ�����Թܿڣ�����ֽ��������˵�����ռ��������ò�����պȡŨ������Թܿڣ����а������ɣ���˵�����ռ�������
�ʴ�Ϊ����ʪ��ĺ�ɫʯ����ֽ�����Թܿڣ�����ֽ��������˵�����ռ��������ò�����պȡŨ������Թܿڣ����а������ɣ���˵�����ռ�������
��5��Ϊ��ֹ������������ֹ�ռ��İ�����������Ҫ���Թܿ���һ���������Թܿڷ������������Ƿ�ֹ�����백���������ռ����������İ�����
�ʴ�Ϊ����ֹ�����백���������ռ����������İ�����
��6��A���������ܶ�С�ڿ����ܶȣ��Һ���������Ӧ�������ռ��������Բ��������ſ������ռ�����A����ȷ��
B��������л������ã������ܷ�ֹ��������B����ȷ��
C����ˮ��ˮ��Ӧ����һˮ�ϰ���һˮ�ϰ��ܵ�������������Ӷ�ʹ����Һ�ʼ��ԣ�������̪��Һ���ɫ����C����ȷ��
D��������л������ã��ձ���Һ�岻�ܽ�����ƿ�У����Բ����γɺ�ɫ��Ȫ����D�����
��ΪD��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С���ͬѧΪ̽���ͱȽ�SO2����ˮ��Ư���ԣ���������µ�ʵ��װ��.
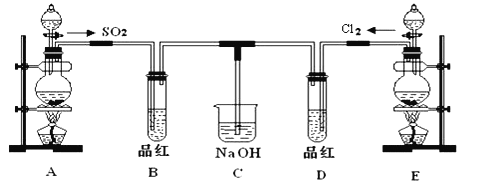
(1)ʵ������װ��A�Ʊ�SO2ijͬѧ��ʵ��ʱ���ִ�A�ķ�Һ©��������,©����Һ��δ����,����Ϊԭ�������__________.
(2)ʵ������װ��E�Ʊ�Cl2,�䷴Ӧ�Ļ�ѧ����ʽΪ__________;����8mol��HCl�μӷ�Ӧ,��ת�Ƶĵ�������Ϊ__________.
(3)��װ��������������Һ��������__________
(4)ͨ����B��D�����Թ��е�����ֱ�ΪB��________D��________.ֹͣͨ����,�ٸ�B��D�����Թֱܷ����,�����Թ��е�����ֱ�ΪB��______________D��___________.
(5)��һ��ʵ��С���ͬѧ��ΪSO2����ˮ����Ư���ԣ�����Ϻ��Ư���Կ϶����ǿ.���ǽ��Ƶõ�SO2��Cl2��1:1ͬʱͨ�뵽Ʒ����Һ�У��������Ʒ�����ɫ_________.��������������ԭ��(�û�ѧ����ʽ��ʾ)__________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��̼�Ļ������������������е�Ӧ�÷dz��㷺�� �ֽ���ͬ����CO2��g����H2��g���ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У��������·�Ӧ��CO2(g��+H2��g��![]() [Failed to download image : ]CO��g��+H2O��g�����õ������������ݣ�
[Failed to download image : ]CO��g��+H2O��g�����õ������������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | |
CO2 | H2 | CO | |||
1 | 800 | 4 | 2.5 | 1.5 | 5 |
2 | 830 | 2 | 2 | 1 | 3 |
3 | 830 | 2 | 2 | 1 | 1 |

��1��ʵ��1�У�ƽ�ⳣ��K=0.9��v��H2��=0.15mol/��Lmin���÷�Ӧ������ӦΪ______��������š����ȷ�Ӧ��
��2��ʵ��3��ʵ��2��ȣ��ı������������___________________________
����һ��������ɣ������÷�Ӧ����ͼ��ʾ�Ĺ�ϵ������ͼ��Y���ʾ___________________________
��3�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������______����ѡ�۷֣���
a��������ѹǿ���� b�����������c��CO ������
c��v��H2����=v��H2O���� d��c��CO2��=c��CO��
��4��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2��c��H2��=c��CO��c��H2O���ɴ˿����жϴ�ʱ���¶�Ϊ______�������������䣬�����¶ȣ�ԭ��ѧƽ����______��Ӧ�����ƶ�����������桱���������ڻ��������ܶ�______�����������С�����䡱����
��5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҫ0.80 mol��L��1 NaOH��Һ475 mL ��0.40 mol��L��1����500 mL��������������Һ����������ش��������⣺
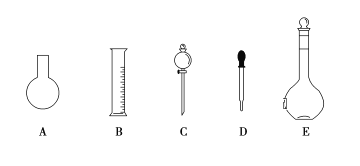
(1)��ͼ��ʾ��������������Һ�϶�����Ҫ����____________(�����)������������Һ�����õ��IJ���������____________________(����������)��
(2)����ƿ�����߱��Ĺ�����________(�����)��
A������һ�����ȷŨ�ȵı���Һ
B����ȡһ�������Һ��
C����������ƿ������µ����������Һ��
D��������Һ
E�����������ܽ��������
(3)���ݼ�����������ƽ��ȡNaOH������Ϊ___________g��
(4)��ʵ����������������ȷ��������ƿ������ˮϴ�Ӻ�δ�����������ҺŨ��________0.80 mol��L��1(����������������������С��������ͬ)������δ����Һ��ȴ�Ͷ����ˣ���������ҺŨ��________0.80 mol��L��1��
(5)���ݼ����֪��������������Ϊ98%���ܶ�Ϊ1.84 g��cm��3��Ũ��������Ϊ________mL(����������һλС��)�����ʵ������10 mL��15 mL��20 mL��50 mL����Ͳ�����ѡ��________mL����Ͳ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��200mL 1molL��1���Ȼ�����Һ�м���һ�������2molL��1��NaOH��Һ�����ղ���7.8g������������NaOH��Һ���������Ϊ
��350mL ��90mL ��150mL ��200mL
A. ֻ�Т� B. �٢� C. �ڢ� D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ�п��ܺ���Mg2+��Ba2+��Cl-��HCO3-�е�һ�ֻ������ӡ�Ϊȷ����ɷ֣���������ʵ�飺
ʵ��1��ȡl0mL��ɫ��Һ���μ�����ϡ��������������
ʵ��2����ȡl0mL��ɫ��Һ������������Na2SO4��Һ���а�ɫ�������ɡ�
ʵ��3����ʵ��l�����Һ����ƿ�У�����ƿ����μ���NaOH��Һ���μӹ����в������������������NaOH��Һ������Ĺ�ϵ��ͼ��ʾ��

�ش��������⣺
��1��ԭ��Һ�в����ڵ�������________�����ڵ�������___________________��
��2��ʵ��3�У�ͼ����OA�η�Ӧ�����ӷ���ʽΪ___________________��
��3������ͼ�����ԭ��Һ��Mg2+�����ʵ���Ũ��______________����д��������̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�������Һ�ĵ�����װ���У�����ijһ�������Һ����μ�����һ����Һʱ����ƹ������䰵��Ϩ�������������

A. ��������μ���ʳ����Һ
B. NH4Cl��Һ�м���������NaOH��Һ
C. Ba(OH)2��Һ�е���H2SO4��Һ������
D. ��������μ��백ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ����£�����ͼ��ʾ��װ���У���ʹ�������ƣ����´ﵽƽ��ʱ��������ֵ���������

A. ��������Ŀ B. HCO3����ˮ��ƽ�ⳣ�� C. ��Һ��pH D. c(HCO3��)/c(H2CO3)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�о���ѧϰС���ij��ɫˮ���ijɷֽ��м��飬��֪��ˮ����ֻ���ܺ���K+��Mg2+��Fe3+��Cu2+��Al3+��Ag+��Ca2+��CO![]() ��SO
��SO![]() ��Cl���е����������ӣ���С��ͬѧȡ100mLˮ������ʵ�飬��ˮ�����ȵμ����ᱵ��Һ���ٵμ�1mol/L�����ᣬʵ������г��������ı仯�������ͼ��ʾ������ʾ:Al3+��CO
��Cl���е����������ӣ���С��ͬѧȡ100mLˮ������ʵ�飬��ˮ�����ȵμ����ᱵ��Һ���ٵμ�1mol/L�����ᣬʵ������г��������ı仯�������ͼ��ʾ������ʾ:Al3+��CO![]() �����棩
�����棩

��1��ˮ����һ�����е���������_____�������ʵ���Ũ��֮��Ϊ_____��
��2��д��BC������ʾ��Ӧ�����ӷ���ʽ��_____��
��3����B��C��仯������������������Ϊ_____��
��4���Ը���ʵ�����Ʋ�K+�Ƿ���ڣ�_____���������������������������ڣ�K+�����ʵ���Ũ��c��K+���ķ�Χ��_____������K+�����ڣ��ػش���ʣ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com