
A、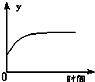 表示反应进行过程中气体平均相对分子质量的变化 |
B、 表示反应进行过程中气体密度的变化 |
C、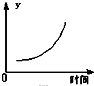 表示反应达到平衡后,移去一些焦炭后水蒸气的百分含量的变化(忽略表面积的影响) |
D、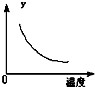 表示反应达到平衡后,升高温度CO的百分含量的变化 |
| 2+12+16 |
| 2 |
| 总质量 |
| 体积 |
| 2+12+16 |
| 2 |
| 总质量 |
| 体积 |


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
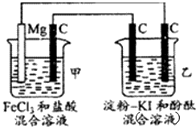
| A、甲池中Mg极为阳极,电极反应式为:Mg-2r-═Mg2+ |
| B、甲池中:当Mg减少2.4g时,石墨(C)极上产生2.24L气体 |
| C、乙池中将化学能转化为电能 |
| D、乙池左侧石墨电极附近变蓝,右侧石墨电极附近变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
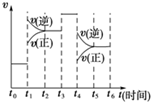 反应N2(g)+3H2(g)
反应N2(g)+3H2(g)
| ||
| △ |
| A、t0~t1 |
| B、t2~t3 |
| C、t3~t4 |
| D、t5~t6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2a+3(b+d-e)+c kJ/mol |
| B、a+3(2b+d-e)-c kJ/mol |
| C、3(d+e-b)+c-2a kJ/mol |
| D、2a+3(b-d-e)-c kJ/mol |
| E、2a+3(b-d-e)-c kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有NA个氢原子的氢气在标准状况下的体积约为11.2L |
| B、25℃,1.01×105Pa,64g SO2中含有的原子数为3NA |
| C、在常温常压下,35.5g Cl2含有的分子数为0.5NA |
| D、标准状况下,11.2L H2O含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑤ | B、①③④⑥ |
| C、①④⑥ | D、①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com