
| A、钠和铜 |
| B、NaCl和K2S04 |
| C、NaCl和Na2C03 |
| D、KCl和NaCl |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
| 序号 | 实验内容 | 实验目的 |
| A | 室温下,使用pH计测定浓度均为0.1mol/L NaClO溶液和CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 室温下,向两支装有同体积同浓度H2O2溶液的试管中,分别加入3滴同浓度的 CuSO4、FeSO4溶液 | 比较CuSO4、FeSO4作为催化剂对H2O2分解速率的影响 |
| C | 向0.1mol/L AgNO3溶液中滴加0.1mol/L NaCl溶液,至不再有白色沉淀生成,再向其中滴入0.1mol/L KI溶液,观察沉淀颜色变化 | 比较AgCl、AgI的溶解度相对大小. |
| D | 向含有少量FeCl3的MgCl2酸性溶液中加入足量Mg(OH)2,加热并搅拌,过滤 | 除去MgCl2酸性溶液中含有的少量FeCl3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
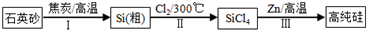
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | ||
| ② |
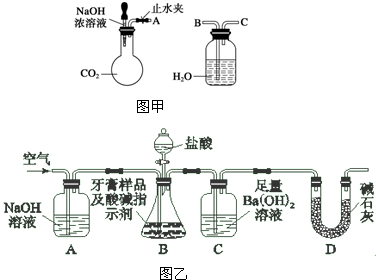
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
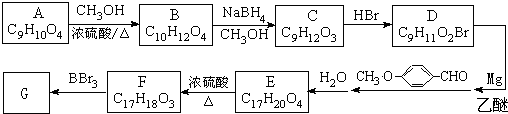
科目:高中化学 来源: 题型:
| ① |
| ② |
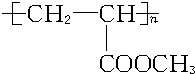 ,请写出设计合成实验时所涉及的有机反应类型:
,请写出设计合成实验时所涉及的有机反应类型:查看答案和解析>>
科目:高中化学 来源: 题型:
 ).
).


 有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:
有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:查看答案和解析>>
科目:高中化学 来源: 题型:
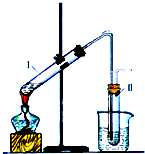 如图是实验室制取溴乙烷的装置示意图,烧杯中装有自来水,试管I和试管II中均事先装有少量蒸馏水.请回答下列问题:
如图是实验室制取溴乙烷的装置示意图,烧杯中装有自来水,试管I和试管II中均事先装有少量蒸馏水.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,
如图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,| a极板 | b极板 | a电极 | Z溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 正极 | CuCl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com