
| A. | 胶体 | B. | 溶液 | C. | 悬浊液 | D. | 乳浊液 |
科目:高中化学 来源: 题型:选择题
| A. | 该反应是氧化还原反应 | B. | Cu是氧化剂 | ||
| C. | CO是还原剂 | D. | 该反应中有电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维的主要成分是二氧化硅 | |
| B. | SiO2不与水反应,所以二氧化硅不是酸性氧化物 | |
| C. | 装有烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱与二氧化硅反应生成硅酸钠而使瓶塞与瓶口黏在一起 | |
| D. | 晶体硅是良好的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
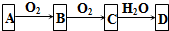
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大氧气浓度,平衡正向移动,平衡常数不变 | |
| B. | 降低温度,正反应速率比逆反应速率减小的程度小 | |
| C. | 平衡时SO2气体的转化率为50% | |
| D. | 该条件下反应放出0.5QkJ的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com