已知H2S和 SO2 反应生成 S和 H2O
①写出反应的化学方程式并标出电子转移的方向和数目______
②上述反应中被氧化的硫原子和被还原的硫原子的物质的量之比为______
③现有H2S和 SO2混合气体1mol,充分反应后得到的产物中,若还原产物比氧化产物少1.6g,则反应中转移电子数为______NA,原混合物中H2S和 SO2的物质的量可能各是多少______
【答案】
分析:①H
2S+SO
2→S+2H
2O的反应中,硫化氢中硫元素失电子由-2价→0价,二氧化硫中硫元素由+4价→0价,所以得失电子的最小公倍数是4,则硫化氢的计量数是2,二氧化硫的计量数是1,然后根据原子守恒配平方程式得2H
2S+SO
2=3S+2H
2O,根据化合价变化写出反应的化学方程式并标出电子转移的方向和数目;
②在氧化还原反应中,还原剂被氧化,氧化剂被还原,根据反应方程式知,反应中被氧化的硫原子和被还原的硫原子的物质的量之比;
③根据氧化产物和还原产物的质量差与转移电子之间的关系式计算;分情况讨论,如果硫化氢过量计算出硫化氢和二氧化硫的物质的量,再根据二氧化硫过量计算出硫化氢和二氧化硫的物质的量.
解答:解:①H
2S+SO
2→S+2H
2O的反应中,硫化氢中硫元素失电子由-2价→0价,二氧化硫中硫元素由+4价→0价,所以得失电子的最小公倍数是4,则硫化氢的计量数是2,二氧化硫的计量数是1,然后根据原子守恒配平方程式得2H
2S+SO
2=3S+2H
2O,该反应的化学方程式及电子转移的方向和数目为:
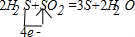
,
故答案为:

;
②该反应中硫化氢是还原剂,二氧化硫是氧化剂,且硫化氢和二氧化硫分子中都含有一个硫原子,根据方程式知,被氧化的硫原子和被还原的硫原子的物质的量之比为2:1,故答案为:2:1;
③设转移电子数为x,
2H
2S+SO
2=3S+2H
2O 转移电子 氧化产物和还原产物的差
4N
A 32g
x 1.6g
x=
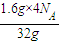
=0.2N
A,
假设硫化氢完全反应,则硫化氢的物质的量为y,
2H
2S+SO
2=3S+2H
2O 氧化产物和还原产物的差
2mol 32g
y 1.6g
y=
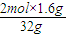
=0.1mol,则二氧化硫的物质的量=(1-0.1)mol=0.9mol;
假设二氧化硫完全反应,则二氧化硫的物质的量为z,
2H
2S+SO
2=3S+2H
2O 氧化产物和还原产物的差
1mol 32g
z 1.6g
z=

=0.05mol,则硫化氢的物质的量=(1-0.05)mol=0.95mol,
故答案为:0.2;
 或
或 .
.
点评:本题考查氧化还原反应的有关计算,难点是③的计算,注意这两种物质不是恰好反应,有过量计算,为易错题.

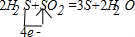 ,
, ;
;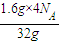 =0.2NA,
=0.2NA,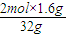 =0.1mol,则二氧化硫的物质的量=(1-0.1)mol=0.9mol;
=0.1mol,则二氧化硫的物质的量=(1-0.1)mol=0.9mol; =0.05mol,则硫化氢的物质的量=(1-0.05)mol=0.95mol,
=0.05mol,则硫化氢的物质的量=(1-0.05)mol=0.95mol, 或
或 .
.


