
【题目】所有原子都在一条直线上的分子是
A.C2H4B.C2H2C.C2H6D.CH4
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A. 所有的烷烃在光照条件下都能与氯水发生取代反应
B. 1mol 葡萄糖能水解生成2molCH3CH2OH和2molCO2
C. 乙酸与乙酸乙酯的相互转化,不属于同一种有机反应类型
D. 仅用碳酸钠溶液可以鉴别乙酸、苯和乙醇三种无色溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如下图装置①。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列有关叙述不正确的是
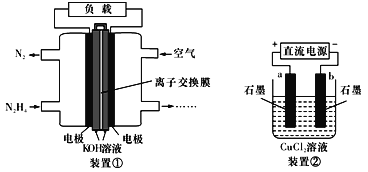
A. 该燃料电池负极发生的电极反应为:N2H4+4OH-4e-==N2↑+4H2O
B. 用该燃料电池作为装置②的直流电源,产生7.1g Cl2至少需加入0.5 mol N2H4
C. 该燃料电池中,电子从左侧电极经外电路流向右侧电极,溶液OH-迁移到左侧
D. 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些物质的有关数据如下表,回答以下问题:

实验一 乙醇在铜的催化下转化为乙醛
将一束质量为w的铜丝灼烧变黑后,迅速插入装有乙醇的试管a中。
(1)铜丝上可观察到的现象是________________________,解释该现象的化学反应方程式为_________________________________________;
(2)若要证明铜丝起催化作用,还需要进行的操作是________________________________;
实验二 乙醛的提纯
上述实验获得的乙醛含有较多乙醇,可以通过以下操作提纯。

已知:![]() (α-羟基乙磺酸钠)
(α-羟基乙磺酸钠)
(3)操作A的名称是 _____________________;
(4)写出Na2CO3溶液参与反应的化学方程式:______________________________;
(5)某同学设计操作B的装置(夹持和加热装置已略去)如图所示。

①冷凝管中的液体应从 ________口进。(填“D”或“E”)
②下列有关操作与装置的分析,正确的是_________。(填字母)
a. 烧杯中应装冰水
b. 冷凝管应通温水
c. 图示装置可用于除去乙酸乙酯中混有的乙醇
实验三 乙醛溶液浓度的测定
室温下利用反应Na2SO3+CH3CHO+H2O→CH3CH(OH)SO3Na↓+NaOH可以测定“实验一”中试管a内乙醛溶液浓度,操作如下:
取试管a中溶液4mL,加入1mL饱和Na2SO3溶液(过量),再加入5mL水,充分振荡后用pH计测定溶液pH;另取试管b,加入4mL乙醇做空白试验,实验结果如右表:
实验 试管 | pH | ||
第1次 | 第2次 | 笫3次 | |
a | 12.42 | 12.40 | 12.38 |
b | 10.43 | 10.43 | 10.40 |
(6)试管a中乙醛溶液的物质的量浓度为______________mol·L-1。(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在pH=5时沉淀完全)。其中分析错误的是( )

A.步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B.步骤②可用氯水、硝酸等强氧化剂代替H2O2
C.步骤③用 CuCO3代替CuO也可调节溶液的pH
D.步骤⑤的操作为:向漏斗中加人少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作2-3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖类的说法正确的是( )
A. 麦芽糖水解生成互为同分异构体的葡萄糖和果糖
B. 糖类都有甜味,具有CnH2mOm的通式
C. 淀粉和纤维素都属于多糖类天然高分子化合物
D. 用银镜反应可以判断淀粉水解是否完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀废液的综合利用有利于减少重金属对水体的污染。某实验小组用以下流程模拟利用一定量工业电镀废液(强酸性,含Cr2O72-、杂质Cu2+等)制备水溶性皮革鞣剂Cr(OH)SO4。回答下列问题:
(已知lg2=0.3,Ksp[ Cr(OH)3]=6.4×10-31, Ksp[ Cu(OH)2]=2×10-20 )

(1)加Na2SO3前先将废液调为弱酸性溶液的原因是__________________,写出废液中加Na2SO3时发生反应的离子方程式_____________。
(2)步骤①须保持温度在30~50℃,可采用的措施是___________________。
(3)步骤②的操作名称是___________。
(4)若在步骤②中,使Cr3+完全沉淀,则溶液的pH范围为______________,
[已知溶液中c(Cu2+)=2×10-4mol·L-1,完全沉淀时c(Cr3+)<10-5 mol·L-1]
(5)粗产品中含有微量CrO42-,工业选择的试剂X应满足的条件是__________。
A.与水互不相溶 B.CrO42-在X中溶解度小
C.Cr(OH)SO4在X中溶解度大 D.Cr(OH)SO4与X不反应
(6)若工业电镀废液含0.1mol Cr2O72-,最终制得产品31.35g,则产率为__________。
(7)酸性条件下,蔗糖还原Na2Cr2O7也可制备Cr(OH)SO4:
Na2Cr2O7+NaHSO4+C12H22O11→Cr(OH)SO4+Na2SO4+H2O+CO2(未配平)
①反应中每生成1molCr(OH)SO4,理论上需要C12H22O11_________mol
②将生成液降温至17℃以下,静置,过滤,在80℃时蒸发滤液,得到标准的工业产品,该产品中混有的主要杂质是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com