
| A. | 8g O2 | B. | 0.3mol NaCl | ||
| C. | 标准状况下4.48L CH4 | D. | 含有3.01×1022个氧原子的H2SO4 |
分析 根据n=$\frac{m}{M}$计算氧气物质的量,根据n=$\frac{V}{{V}_{m}}$计算甲烷物质的量,D中根据n=$\frac{N}{{N}_{A}}$计算O原子物质的,结合化学式计算原子物质的量进行判断.
解答 解:A.8g O2的物质的量为$\frac{8g}{32g/mol}$=0.25mol,含有原子物质的量为0.5mol;
B.0.3mol NaCl含有原子物质的量为0.6mol;
C.标准状况下4.48L CH4的物质的量$\frac{4.48L}{22.4L/mol}$=0.2mol,含有原子物质的量为0.2mol×5=1mol;
D.3.01×1022个氧原子的物质的量为$\frac{3.01×1{0}^{22}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.05mol,则硫酸分子含有原子物质的量为0.05×$\frac{7}{4}$=0.0875mol.
故选:C.
点评 本题考查物质的量有关计算,比较基础,熟练掌握以物质的量为中心的计算,理解化学式的意义.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
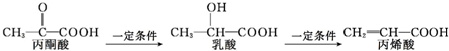
| A. | 三种有机物中都存在2种官能团 | |
| B. | 乳酸和丙烯酸都能使高锰酸钾酸性溶液褪色 | |
| C. | 1 mol乳酸最多能与2 mol Na发生反应 | |
| D. | 三种有机物均能发生聚合反应生成高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食醋 | B. | 白酒 | C. | 食盐 | D. | 葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用激光笔照射煮沸过的FeCl3溶液可观察到明亮光路 | |
| B. | 大雾天气用汽车远光灯照射前方常出现明亮光路 | |
| C. | 明矾可用作净水剂 | |
| D. | 臭氧、Cl2均可用于水的消毒净化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的淀粉碘化钾试纸检验是否有Cl- | |
| B. | 用托盘天平称取12.6g Na2SO4固体粉末 | |
| C. | 通过分液方法分离酒精和水 | |
| D. | 将250g Cu2SO4•5H2O固体溶于1L水,配制1 mol•L-1 CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
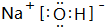 ,
,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com