
对于常温下0.1 mol·L-1氨水和0.1 mol·L-1醋酸,下列说法正确的是
A.0.1 mol·L-1氨水,溶液的pH=13
B.0.1 mol·L-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小
C.0.1 mol·L-1醋酸溶液中:c(H+)=c(CH3COO-)
D.0.1 mol·L-1醋酸与0.1 mol·L-1NaOH溶液等体积混合所得溶液中:
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
某有机物的结构简式如图所示。1 mol该有机物与足量的NaOH溶液共热,充分反应后最多可消耗NaOH的物质的量为( )

A.2 mol B.6 mol C.8 mol D.4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,有关说法不正确的是
A.元素e的氧化物对应的水化物均为强酸
B.a、b、d、e四种元素的离子半径:
C.b、f两种元素形成的化合物为离子化合物
D.a、c、e的最高价氧化物对应的水化物之间能够相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
氨气在工农业生产中有重要应用。
24、 氮原子的最外层的电子排布式是______________,氮原子核外共有_______种不同能量的电子。
25、如下图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。

②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是
③FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括
Fe2+ + 2NH3·H2O → Fe(OH)2↓+ 2NH4+ 和 _________ 。(化学方程式)
26、空气吹脱法是目前消除NH3对水体污染的重要方法。在一定条件下,向水体中加入适量NaOH可使NH3的脱除率增大,用平衡移动原理解释其原因 。
27、在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为 ,若反应中有0.3 mol电子发生转移时,生成亚硝酸的质量为 g(小数点后保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知: Cu (s)+2H+ (aq)=Cu2+(aq)+ H2 (g) △H 1
2H2O2(l)=2H2O(l) + O2 (g) △H 2
2H2 (g) + O2 (g)=2H2O(l) △H 3
则反应 Cu (s)+H2O2(l)+2H+ (aq)=Cu2+(aq)+ 2H2O(l) 的△H是
A.△H=△H 1+ △H 2+
△H 2+ △H 3 B.△H=△H 1+
△H 3 B.△H=△H 1+ △H 2-
△H 2- △H 3
△H 3
C.△H=△H 1+2△H 2+2△H 3 D.△H=2△H 1+△H 2+△H 3
查看答案和解析>>
科目:高中化学 来源: 题型:
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:

(1)“酸浸”过程中主要反应的离子方程式为_____________、_________________。
(2)“酸浸”时铝浸出率的影响因素可能有_____________、___________。(写出两个)
(3)物质X的化学式为___________。“碱溶”时反应的离子方程式为____________。
(4)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得产品Al(OH) 3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是____________________。
(5)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的说法正确的是
A.除去铁粉中的铜粉,加入足量浓硫酸加热反应后进行过滤
B.不用任何其他试剂就可以鉴别NaOH溶液和Al2(SO4)3溶液
C.制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中
D.某溶液加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液一定含有大量CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。
下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e- == Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子能大量共存且有两种离子因对方的存在抑制了水解的是
A.Na+、HCO 、Cl-、SO
、Cl-、SO B.Al3+、K+、SO
B.Al3+、K+、SO 、Cl-
、Cl-
C.Fe2+、NH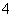 、SO
、SO 、K+ D.Mg2+、ClO-、OH-、HSO
、K+ D.Mg2+、ClO-、OH-、HSO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com