
| 实验 次数 | H2O2溶液 质量分数% | H2O2溶液用量/毫升] | 物质D 用量/克 | 反应 温度/℃ | 收集气体体积/毫升 | 所需 时间/秒 |
| ① | 30 | 5 | 0 | 85 | 2 | 3.8 |
| ② | 15 | 2 | 0.1 | 20 | 2 | 2.8 |
| ③ | 15 | 2 | 0.2 | 20 | 2 | 2.2 |
| ④ | 5 | 2 | 0.1 | 20 | 2 | 7.4 |
| ⑤ | 30 | 5 | 0 | 55 | 2 | 10.5 |
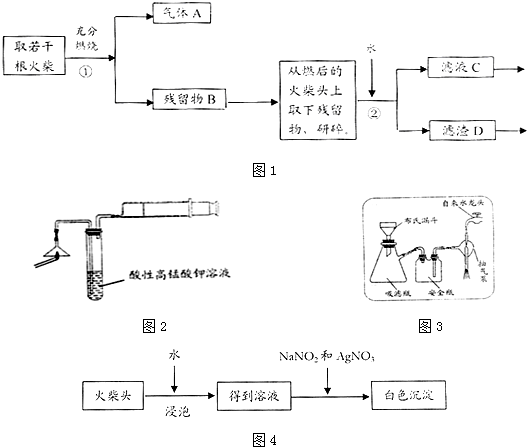
分析 (1)火柴头中含有硫能燃烧,S与O2反应生成了SO2,SO2具有还原性,可用酸性高锰酸钾溶液来检验;
(2)依据火柴头上含有KClO3、MnO2、S物质的性质分析判断,氯酸钾在二氧化锰做催化剂作用分解生成氯化钾和氧气,硫单质燃烧和氧气反应生成二氧化硫气体;
(3)根据装置图可知装置名称;
(4)氯离子和酸性硝酸银溶液反应生成不溶于稀硝酸的白色沉淀;
(5)依据流程分析,氯酸钾在酸性溶液中能氧化氯离子为氯气;氯气和碘化钾反应生成碘单质,遇到淀粉变蓝;
(6)根据图表知,当其它条件都相同只有D的量不同时能证明D的用量与反应速率的关系.
解答 解:(1)从氧化还原反应角度考查SO2的检验可用KMnO4溶液,SO2具有还原性,能被KMnO4溶液氧化,
故答案为:KMnO4溶液(紫红色)褪色;
(2)步骤①中发生的与此相关的两个主要反应的方程式:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+O2↑、S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,故答案为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+O2↑、S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;
(3)根据装置图可知,该装置名称是减压过滤,故答案为:减压过滤(或抽滤);
(4)氯离子和酸性硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,取滤液C,加入HNO3和AgNO3溶液,若观察到白色沉淀产生,即可证明火柴头中含有氯元素,
故答案为:取滤液C,加入HNO3和AgNO3溶液,若观察到白色沉淀产生,即可证明火柴头中含有氯元素;
(5)依据流程分析,氯酸钾在酸性溶液中能氧化氯离子为氯气,反应的离子方程式为:ClO3-+5Cl-+6H+═3Cl2↑+3H2O;氯气和碘化钾反应生成碘单质,反应的离子方程式为:Cl2+2I-═I2+2Cl-;碘单质遇到淀粉变蓝;上述方法中出现的现象并不能充分说明火柴头上有KClO3的存在,因为二氧化锰和浓盐酸加热也发生反应生成氯气,
故答案为:ClO3-+5Cl-+6H+═3Cl2↑+3H2O、Cl2+2I-═I2+2Cl-;MnO2与浓盐酸共热也可产生氯气;
(6)据图表知,当其它条件都相同只有D的量不同时能证明D的用量与反应速率的关系,则实验②和③能证明证明物质D的用量越大,反应速率越快,实验①和⑤能证明温度越高,反应速率越快;实验②和④证明H2O2的质量分数越大,反应速率越快,
故答案为:①;⑤;②;③.
点评 本题考查了物质现在的实验分析验证和实验基本操作,物质性质的理解应用时解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CaCO3 | B. | NH4HCO3 | C. | Na2CO3 | D. | NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝离子 | B. | 氢氧化铝 | ||
| C. | 四羟基合铝酸根离子 | D. | 铝离子和氢氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使酚酞试液变红的溶液中:Na+、Cl-、SO42-、Fe3+ | |
| B. | c(H+):c(OH-)=105:1的溶液中:K+、HCO3-、Cl-、Na+ | |
| C. | c(H+)=1.0×10-13mol•L-1的溶液中:Na+、SO42-、Al(OH)4-、CO32- | |
| D. | 强酸性溶液中:NH4+、I-、Fe2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .该物质含有的化学键为:离子键和非极性键.
.该物质含有的化学键为:离子键和非极性键.| 稳定性 | 粒子半径 | 熔点 | 键的极性 |
| NH3<H2O | O2-> Mg2+ | SO3< Na2O2 | H-O> H-N |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1CaCl2溶液中所含Ca2+离子的数目为NA | |
| B. | 100g质量分数为36.5%的浓盐酸中所含HCl分子数为NA | |
| C. | 标况下,11.2LBr2含有的分子数为0.5 NA | |
| D. | 4.6gNa与100mL含0.1molHCl的盐酸溶液反应,转移电子数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com