
科目:高中化学 来源: 题型:
取质量为4.6g的纯净的金属钠平均分成两等份,做如下实验:
(1)第一块直接投入适量的水中,充分反应后得到了气体A和200mL溶液(甲);
(2)另一块在干燥氧气中受热后转化成3.5g固体(经检验固体中不含金属钠的单质),再将所得固体全部投入适量的水中,充分反应后得到气体B和200mL溶液(乙)。求:
①同温同压下,气体A和气体B的密度之比为 ;
②溶液甲的物质的量浓度= ;
③溶液的物质的量浓度:甲 乙(填“>”、“=”、“<”、“无法确定”);
④3.5g固体所含成分是 。
A.只含Na2O B. 只含Na2O2
C.既含Na2O又含Na2O2 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
要除去KNO3溶液中混有的少量Ba(NO3)2杂质,得到纯净的KNO3溶液,操作正确的是( )
A.加入适量的Na2CO3溶液,过滤
B.加入足量的K2CO3溶液,过滤
C.先加入过量的K2CO3溶液,过滤,再向滤液中加入适量的稀HNO3
D.先加入过量的K2CO3溶液,过滤,再向滤液中加入适量的稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
判断下列说法是否正确。
(1)从1 L 1 mol·L-1的NaCl溶液中取出100 mL溶液,其物质的量浓度为0.01 mol·L-1。( )
(2)将80 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 mol·L-1。( )
(3)1 L 1 mol·L-1的NaCl溶液和1 L 1 mol·L-1的蔗糖溶液,所含溶质的物质的量相等。( )
(4)1 mol·L-1 Na2SO4溶液中含有1 mol Na2SO4。( )
(5)0.2 mol·L-1的Ba(NO3)2溶液中NO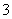 的浓度为0.2 mol·L-1。( )
的浓度为0.2 mol·L-1。( )
(6)配制一定物质的量浓度的溶液时,所用容量瓶未干燥则导致所配溶液浓度偏低。( )
查看答案和解析>>
科目:高中化学 来源: 题型:
下列配制的溶液浓度偏高的是( )
配制硫酸用量筒量取硫酸时俯视刻度线
配制盐酸定容时,仰视容量瓶刻度线
NaOH溶解后未经冷却即注入容量瓶至刻度线
称量4gNaOH配制0.1mol/L NaOH溶液1000ml时,砝码错放左盘
查看答案和解析>>
科目:高中化学 来源: 题型:
将250mLH2SO4的质量分数为98%,密度为1.84g/cm3的浓硫酸稀释到1000mL。
(1)稀释前溶液中H2SO4的物质的量浓度是多少?
(2)稀释后溶液中H+的物质的量浓度是多少?
(3 )若要制取3.36LH2 (标准状况),则要用量筒量取稀释后的硫酸溶液多少毫升?
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达错误的是
| |
C.质量②>③>①>④ D.氢原子个数①>③>④>②
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼—空气燃料电池放电时:
负极的电极反应式是 ;
正极的电极反应式是 。
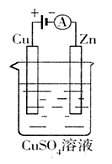 |
(3)下图是一个电化学过程示意图。
①锌片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com