
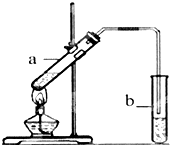
 葡萄可用于酿酒.
葡萄可用于酿酒.分析 (1)葡萄糖中含有醛基,能被新制的氢氧化铜悬浊液氧化,所以实验现象是产生砖红色沉淀;
(2)根据碳原子和氧原子守恒可知,另外一种生成物是CO2;
(3)①乙酸和乙醇在浓硫酸作用下发生酯化反应,生成乙酸乙酯和水;
②制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,目的是除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层;
③实验开始时,试管b中的导管不伸入液面下的原因是防止倒吸;
④乙酸乙酯不溶于水,分液即可,需要用到的仪器是分液漏斗;
(4)有机物中,只有含有羧基的有机物可以和碳酸氢钠反应产生二氧化碳气体.
解答 解:(1)葡萄糖中含有醛基,能被新制的氢氧化铜悬浊液氧化,所以实验现象是产生砖红色沉淀氧化亚铜,
故答案为:砖红色沉淀;
(2)根据碳原子和氧原子守恒可知,另外一种生成物是CO2,
故答案为:CO2;
(3)①在浓硫酸的作用下,乙醇和乙酸发生酯化反应生成乙酸乙酯,反应的化学方程式是CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
故答案为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
②由于乙醇和乙酸都是易挥发的,所以生成的乙酸乙酯中含有乙醇和乙酸,除去乙醇和乙酸的试剂是饱和的碳酸钠溶液,
故答案为:碳酸钠;
③由于乙醇和乙酸都是和水互溶的,如果直接插入水中吸收,容易引起倒吸,所以试管b中的导管不伸入液面下的原因是防止溶液倒吸.
故答案为:防止倒吸;
④乙酸乙酯不溶于水,分液即可,需要用到的仪器是分液漏斗,
故答案为b;
(4)有机物中,只有含有羧基的有机物可以和碳酸氢钠反应产生二氧化碳气体,验证该有机物中含有-COOH官能团常采用的方法是加入NaHCO3,产生的现象为放出气体,故答案为:加入NaHCO3;放出气体.
点评 本题考查了葡萄糖的性质、乙酸乙酯制备实验的有关探究,该题是基础性实验题的考查,试题紧扣教材,基础性强,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生规范严谨的实验设计能力.明确实验原理,注意葡萄的结构和性质、碳酸钠的作用,注意相关知识的积累和总结.


科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
已知分解1 mol H2O2 放出热量98KJ,在含少量I-的溶液中,H2O2的分解机理为:H2O2+I-→H2O +IO- 慢;H2O2+IO-→H2O+O2+I- 快,下列有关反应的说法正确的是
A.反应的速率与I-的浓度有关 B. IO-也是该反应的催化剂
C.反应活化能等于98KJ·mol-1 D.v(H2O2)=v(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
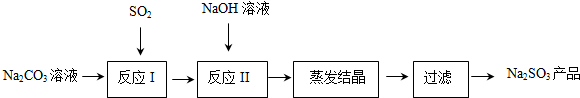
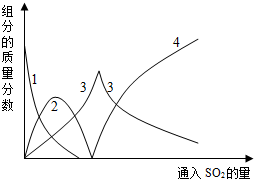
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
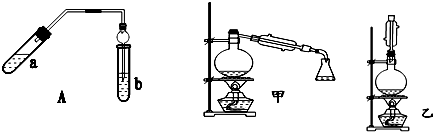
| 实验编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol•L-1 浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
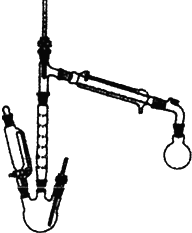 实验室也可用如图所示的装置制取少量乙酸乙酯.(已知乙酸乙酯在水中的溶解度较大,15℃时100g水中能溶解8.5g)
实验室也可用如图所示的装置制取少量乙酸乙酯.(已知乙酸乙酯在水中的溶解度较大,15℃时100g水中能溶解8.5g)查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
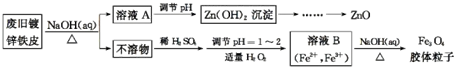
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
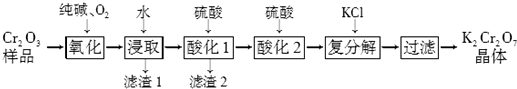
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
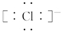 .Al在元素周期表最中的位置是第三周期第IIIA族.
.Al在元素周期表最中的位置是第三周期第IIIA族.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com