
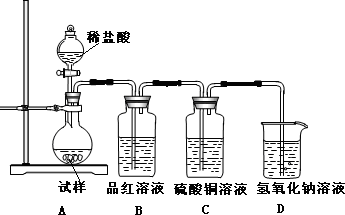
| ||
| ||


科目:高中化学 来源: 题型:
| 原子序数 | 电子层数 | 最外层电子数 | 达到稳定状态时的最外层电子数 |
| 1-2 | 1 | 2 | |
| 3-10 | 2 | 8 | |
| 11-18 | 3 | 8 | |
| 结论:随着原子序数的递增,元素原子的 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
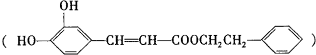 ,在一定条件下能发生如图所示的转化:
,在一定条件下能发生如图所示的转化: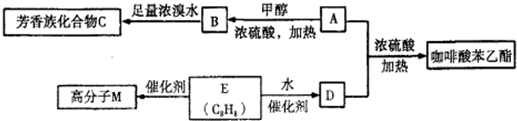
查看答案和解析>>
科目:高中化学 来源: 题型:
A、在pH=1的溶液中,能大量共存的一组离子或者分子:K+、Cr2O
| ||||
| B、c(H+)=10-12mol/L的溶液:Na+、Ba2+、Cl-、Br- | ||||
C、由水电离出的c(H+)=10-14mol/L的溶液:Ca2+、K+、Cl-、HCO
| ||||
| D、0.1mol/L的NaAlO2溶液中:Al3+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 二茂铁(如图)是一种有机过渡金属化合物,不溶于水,易溶于苯、乙醚等有机溶剂.由烃A可制备二茂铁.A分子是一种没有侧链的环状结构,其一氯取代物有三种,1molA最多可与2molBr2加成,其与Br2的1:1加成只得两种产物.
二茂铁(如图)是一种有机过渡金属化合物,不溶于水,易溶于苯、乙醚等有机溶剂.由烃A可制备二茂铁.A分子是一种没有侧链的环状结构,其一氯取代物有三种,1molA最多可与2molBr2加成,其与Br2的1:1加成只得两种产物.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com