
【题目】课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
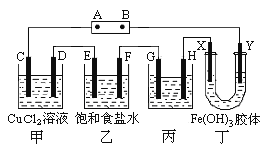
(1)电源A 极的名称是________。
(2)甲装置中电解反应的总化学方程式是__________________。
(3)如果收集乙装置中产生的气体,两种气体的体积比是________。
(4)欲用丙装置精炼铜,G应该是____(填“纯铜”或“粗铜”),电解液的成分是______。
(5)已知氢氧化铁胶体中含有带正电荷的红褐色的粒子,那么装置丁中的现象是________________。
(6)在实验室电解500 mL 0.03 mol/L的NaCl溶液,通电一段时间后溶液中c(OH-)为1×10-2 mol/L(设电解时溶液的体积变化忽略不计),阴极产生___mL(标况)气体,溶液中NaCl的浓度为_______mol/L。
【答案】正 CuCl2![]() Cu+ Cl2↑ 1:1 粗铜 CuSO4或CuCl2 Y极附近红褐色变深 56 0.02
Cu+ Cl2↑ 1:1 粗铜 CuSO4或CuCl2 Y极附近红褐色变深 56 0.02
【解析】
将电源接通后,向乙中滴入酚酞试液,在F极附近显红色,说明F极生成OH-,F为阴极,则可知A为电源的正极,B为电源的负极,C、E、G、X为电解池的阳极,D、F、H、Y为电解池的阴极。然后根据电解原理,结合同一闭合回路中电子转移数目相等计算。
根据上述分析可知:A为电源的正极,B为电源的负极,C、E、G、X为阳极,D、F、H、Y为阴极。
(1)A是电源的正极,B是电源的负极;
(2)用惰性电极电解CuCl2溶液,阳极上Cl-失去电子产生Cl2,阴极上Cu2+得到电子产生Cu单质,反应方程式为:CuCl2![]() Cu+ Cl2↑;
Cu+ Cl2↑;
(3)装置乙是电解饱和NaCl溶液,反应方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,可见反应产生的气体物质的量的比是1:1,在相同条件下气体的体积比为1:1;
2NaOH+H2↑+Cl2↑,可见反应产生的气体物质的量的比是1:1,在相同条件下气体的体积比为1:1;
(4)欲用丙装置精炼铜,在电解精炼铜时,应该粗铜作阳极,纯铜作阴极,含有铜离子的盐作电解质溶液,G连接电源的正极,为阳极,其材料是粗铜,电解液可以CuSO4或CuCl2;
(5)根据同性电荷相互排斥,异性电荷相互吸引的原理,氢氧化铁胶体中含有的带正电荷的粒子会向阴极即向Y极移动,故阴极Y极附近红褐色变深;
(6)电解NaCl饱和溶液,反应总方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,NaCl的物质的量n(NaCl)总=c·V=0.03 mol/L×0.5 L=1.5 ×10-2 mol,反应产生NaOH的物质的量为n(NaOH)=c·V=1×10-2mol/L×0.5 L=5×10-3 mol,根据电解方程式可知:每反应产生2 mol NaOH,同时消耗2 mol NaCl,阴极上产生1 mol H2,则反应产生5×10-3 mol NaOH时,消耗NaCl的物质的量为n(NaCl)耗=n(NaOH)=5×10-3mol,得到H2的物质的量n(H2)=
2NaOH+H2↑+Cl2↑,NaCl的物质的量n(NaCl)总=c·V=0.03 mol/L×0.5 L=1.5 ×10-2 mol,反应产生NaOH的物质的量为n(NaOH)=c·V=1×10-2mol/L×0.5 L=5×10-3 mol,根据电解方程式可知:每反应产生2 mol NaOH,同时消耗2 mol NaCl,阴极上产生1 mol H2,则反应产生5×10-3 mol NaOH时,消耗NaCl的物质的量为n(NaCl)耗=n(NaOH)=5×10-3mol,得到H2的物质的量n(H2)=![]() n(NaOH)=2.5×10-3 mol,其在标准状况下的体积V(H2)=2.5×10-3mol×22.4 L/mol=5.6×10-2 L=56 mL;反应后溶液中剩余NaCl物质的量为1.5 ×10-2 mol-5×10-3 mol=1.0×10-2 mol,其浓度为c(NaCl)=
n(NaOH)=2.5×10-3 mol,其在标准状况下的体积V(H2)=2.5×10-3mol×22.4 L/mol=5.6×10-2 L=56 mL;反应后溶液中剩余NaCl物质的量为1.5 ×10-2 mol-5×10-3 mol=1.0×10-2 mol,其浓度为c(NaCl)=![]() =0.02 mol/L。
=0.02 mol/L。


科目:高中化学 来源: 题型:
【题目】某温度时,向某VL的密闭容器中充入3molH2(g)和3molI2(g),发生反应:H2(g)+I2(g)![]() 2HI(g) △H=-26.5kJmol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。请回答下列问题:
2HI(g) △H=-26.5kJmol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。请回答下列问题:
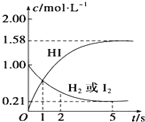
(1)0-5秒内平均反应速率v(HI)=___mol/(Ls)。
(2)该反应达到平衡状态时,放出的热量为___kJ。
(3)判断该反应达到平衡的依据是___(填序号)。
①H2消耗的速率和I2消耗的速率相等
②H2、I2、HI的浓度比为1:1:2
③H2、I2、HI的浓度都不再发生变化
④该条件下正、逆反应速率都为零
⑤混合气体的平均分子量不再发生变化
⑥气体的颜色不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,据此回答:
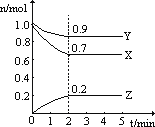
(1)该反应的化学方程式为______。
(2)从开始至2min,Z的平均反应速率为_____mol/(L·min);
(3)改变下列条件,可以加快化学反应速率的有_____。
A.升高温度
B.减小物质X的物质的量
C.减小压强
D.增加物质Z的物质的量
E.缩小容积
F.使用效率更高的催化剂
(4)该反应正向为放热反应若上述容器为绝热容器(与外界无热交换),则到达最大限度所需时间将_____。
a.延长 b.缩短 c.不变 d.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将 2 molSO2 和 1 molO2 充入一定容密闭容器中,在催化剂存在下进行下列反应: 2SO2(g)+O2(g)![]() 2SO3(g);△H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
2SO3(g);△H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
A. 生成 SO3为2 mol
B. 反应放出 197 kJ 的热量
C. SO2和SO3 物质的量之和一定为 2mol
D. SO2、O2、SO3的物质的量之比一定为2:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A2+B2![]() 2AB ΔH=QkJ/mol,在不同温度和压强改变的条件下,产物AB的生成情况如图所示:a为500℃、b为300℃的情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是
2AB ΔH=QkJ/mol,在不同温度和压强改变的条件下,产物AB的生成情况如图所示:a为500℃、b为300℃的情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是
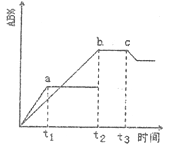
A. A2、B2及AB均为气体,Q>0
B. AB为气体,A2、B2中有一种为非气体,Q>0
C. AB为气体,A2、B2中有一种为非气体,Q<0
D. AB为固体,A2、B2中有一种为非气体,Q>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )

A. 紫色石蕊溶液先变红后褪色B. 品红溶液褪色
C. 溴水橙色褪去D. 含酚酞的NaOH溶液红色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确解释下列反应原理,并且书写正确的离子方程式是
A. 用明矾作净水剂:Al3++3H2O=Al(OH)3↓+3H+
B. 用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O
C. 电解MgCl2饱和溶液制取Mg:MgCl2![]() Mg+Cl2↑
Mg+Cl2↑
D. 用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO32-=CaCO3+SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0达平衡后,改变某一反应条件,反应速率随时间变化的情况。根据曲线判断下列说法中正确的是
2NH3(g) ΔH<0达平衡后,改变某一反应条件,反应速率随时间变化的情况。根据曲线判断下列说法中正确的是

A. t1时降低了温度,平衡向正反应方向移动
B. t1时增大了压强,平衡向正反应方向移动
C. t1时增大了N2的浓度同时减小了NH3的浓度,平衡向正反应方向移动
D. t1时可能使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种易溶于水的二元中强酸,KHC2O4溶液显酸性。现称取5.0g含H2C2O42H2O、KHC2O4和K2SO4的固体样品,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。第一份溶液中加入2滴酚酞试液,滴加0.2500mol/LNaOH溶液,滴定终点时消耗NaOH溶液16.00mL。第二份溶液用0.1000mol/L酸性KMnO4溶液滴定,当加入12.00mL酸性KMnO4溶液时恰好反应完全。
(1)K2C2O4溶液呈碱性的原因(用离子方程式表示)_______________________________。
(2)在该实验中不需要用到的实验仪器有___________(填字母编号)。
A.容量瓶 B.酸式滴定管 C.碱式滴定管 D.分液漏斗 E.锥形瓶 F.圆底烧瓶
(3)第一份用NaOH溶液滴定时,滴定终点的判断依据为____________________________________。
(4)原试样中KHC2O4的质量分数为__________%(保留3位有效数字)。
(5)如果用0.2500mol/LNaOH溶液滴定第一份溶液的实验中,在滴定终点时俯视读数。则测得的KHC2O4的质量分数_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com