
| A. | 使用合适的催化剂可以加大反应速率 | |
| B. | 升高温度可以增大反应速率 | |
| C. | 增大N2浓度可以使H2转化率达到100% | |
| D. | 增大N2浓度可以减小反应速率 |
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的溶液实验中,定容时,俯视观察刻度线,会引起配制溶液的浓度偏高 | |
| B. | 分液漏斗中上层和下层液体均可以从下口流出 | |
| C. | 冷凝管使用时冷水既可以从上口进也可以从下口进 | |
| D. | 不能用丁达尔效应鉴别Fe(OH)3胶体和CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na | B. | FeCl3溶液 | C. | KMnO4酸性溶液 | D. | 溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCOOH+H2O?HCOO-+H3O+ | B. | CO32-+H2O?HCO3-+OH- | ||
| C. | CO2+H2O?HCO3-+H+ | D. | HS-?S2-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用浓盐酸与MnO2反应制Cl2,每生成22.4 LCl2,转移的电子总数为2NA | |
| B. | 1 mol O2在反应中作氧化剂时,所得电子数一定为4NA | |
| C. | 1 mol Na2O2与足量H2O反应,转移电子数为2NA | |
| D. | 0.1 mol金属钠在过量氧气中充分燃烧,生成的化合物中离子总数为0.15NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
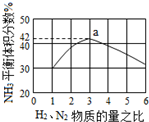 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
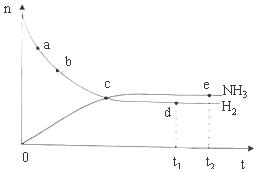 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的小 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 点d(t1时刻)和点e(t2时刻)处H2的转化率相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2(NaOH) | B. | SnCl2(HCl) | C. | FeCl3(HCl) | D. | FeSO4(Fe) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com