
【题目】已知热化学方程式:SO2(g)+ 1/2O2(g) ![]() SO3(g) ΔH=―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
SO3(g) ΔH=―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
A. 196.64kJB. 小于98.32kJ
C. 小于196.64kJD. 大于196.64kJ
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】化学是以实验为基础的科学,以下实验是高一学生必须掌握的基本实验,请根据实验内容完成下列问题;
(1)下图是从海带中提取碘单质的过程:
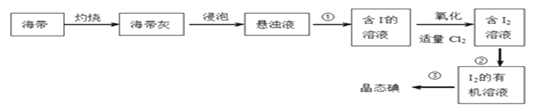
①进行实验①的操作名称是:_________________。
②在进行实验②的过程中,可以选择的有机溶剂是____________。
A.乙醇 B.四氯化碳 C.苯 D. 乙酸
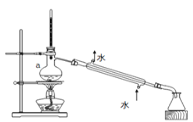
③从I2的有机溶液中提取碘的装置如图所示,仪器a的名称为:_______。
④向含I-的溶液中加入适量氯气发生反应的离子方程式为:__________________________。
(2)下图是实验室制取乙酸乙酯的实验装置,回答下列问题:
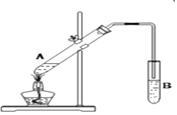
①在A试管中加入试剂的顺序是___________ (填以下字母序号)。
a.先浓硫酸再乙醇后乙酸 b.先浓硫酸再乙酸后乙醇 c.先乙醇再浓硫酸后乙酸
②在试管B中常加入_______________ 来接收乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酒精灯加热时,需要垫石棉网的仪器有 ( )
① 烧杯 ② 坩埚 ③ 锥形瓶 ④ 蒸发皿 ⑤ 试管 ⑥ 烧瓶
A.②④⑤B.①②③C.④⑤⑥D.①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下面的能量变化示意图,下列热化学方程式正确的是

A. 2A(g)+ B(g)=2C(g)△H=a(a>0)B. 2A(g)+ B(g)=2C(g)△H=a(a<0)
C. 2A + B=2 C△H=a(a<0)D. 2C=2A +B△H=a(a>0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、某化学活动小组利用如下甲装置对原电池进行研究,请回答下列问题:(其中盐桥为含有饱和KCl溶液的琼脂)

(1)在甲图装置中,当电流计中指针发生偏转时,盐桥中的离子移动方向为:K+移向_____烧杯(填“A”或“B”),装置中电子的移动路径和方向为___________________________。
Ⅱ、该小组同学提出设想:如果将实验中的盐桥换为导线(铜制),电流表是否也发生偏转呢?带着疑问,该小组利用图乙装置进行了实验,发现电流计指针同样发生偏转。回答下列问题:
(2)该小组的一位成员认为溶液中的阴阳离子能通过铜导线从而构成闭合回路形成电流,该装置仍然为原电池。你对该观点的评价是_________(填“正确”或“不正确”)。
(3)对于实验中产生电流的原因,该小组进行了深入探讨,后经老师提醒注意到使用的是铜导线,烧杯A实际为原电池。那么在烧杯B中铜片上发生反应的电极反应式为______________________。
(4)对于图乙烧杯A实际是原电池的问题上,该小组成员发生了很大分歧:
①一部分同学认为是由于ZnSO4溶液水解显酸性,此时原电池实际是由Zn、Cu做电极,H2SO4溶液作为电解质溶液而构成的原电池。如果这个观点正确,那么原电池的正极反应式为:_________________________________。
②另一部分同学认为是溶液酸性较弱,由于溶解在溶液中的氧气的作用,使得Zn、Cu之间形成原电池。如果这个观点正确,那么原电池的正极反应式为:_________________ 。
(5)若第(4)问中②观点正确,则可以利用此原理设计电池为在偏远海岛工作的灯塔供电。其具体装置为以金属铝和石墨为电极,以海水为电解质溶液,请写出该电池工作时总反应的化学方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列的实验操作中所用仪器合理的是
A.用25 mL的碱式滴定管量取14.80 mL NaOH溶液
B.用100 mL量筒量取5.2 mL盐酸
C.用托盘天平称取25.20 g氯化钠
D.用150 mL容量瓶配制50 mL 0.1 mol/L盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA代表阿伏加德罗常数的数值,则关于热化学方程式C2H2(g)+![]() O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
A. 转移10NA个电子时,该反应放出1300 kJ的能量
B. 生成NA个液态水分子时,吸收1300 kJ的能量
C. 有2NA个碳氧共用电子对生成时,放出1300 kJ的能量
D. 有10NA个碳氧共用电子对生成时,放出1300 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)真空碳热还原-氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g) △H=akJ·mol-1
3AlCl(g)═2Al(l)+AlCl3(g) △H=bkJ·mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=________kJ·mol-1(用含a、b的代数式表示);
(2)已知 2SO2(g)+O2(g)=2SO3(g)△H反应过程的能量变化如图所示,已知1mol SO2(g)氧化为1mol SO3放出99kJ的热量,请回答下列问题:
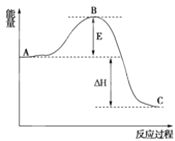
①图中A分别表示______________;
②E的大小对该反应的反应热_________(填“有”或“无”)影响;
③该反应通常用V2O5作催化剂,加V2O5会使图中B点 __________(填“升高”“降低”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com