
| A. |  | B. |  | C. |  | D. |  |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
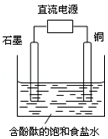 某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )| A. | 铜是电解池的阳极 | B. | 石墨电极附近溶液呈红色 | ||
| C. | 铜电极上产生的是无色气体 | D. | 石墨电极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
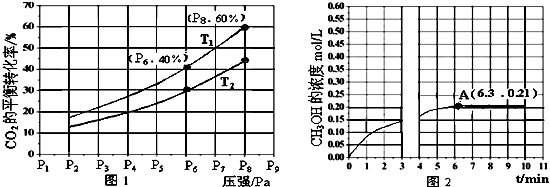
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
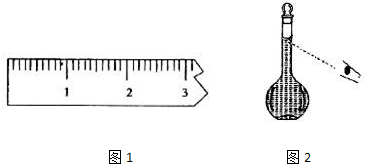
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol OH-中含有9NA个电子 | |
| B. | 常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 | |
| C. | 1 L 1 mol/L AlCl3溶液中含有NA个Al3+ | |
| D. | 常温常压下,11.2 L甲烷气体中含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2固体中阳离子与阴离子的个数比为1:1 | |
| B. | 从试剂瓶中取出并切下的未使用的钠可放回原试剂瓶中 | |
| C. | 将Na投入饱和Na2CO3溶液中,会导致溶液质量增加 | |
| D. | 金属Na失火,可用CO2灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 静电除尘器除去空气中的飘尘是利用胶体粒子的带电性而加以除去 | |
| B. | 溶液和胶体均为呈电中性的分散系 | |
| C. | FeCl3溶液和Fe(OH)3胶体的本质区别是后者可以产生丁达尔现象 | |
| D. | 由于胶粒之间的排斥作用,胶粒不易聚集成大的颗粒,所以胶体比较稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH4(g)+4O2(g)→2CO2(g)+4H2O(1);△H=+890kJ•mol-1 | |
| B. | CH4(g)+2O2(g)→CO2(g)+2H2O(1);△H=+445kJ•mol-1 | |
| C. | CH4(g)+2O2(g)→CO2(g)+2H2O(1);△H=+890kJ•mol-1 | |
| D. | $\frac{1}{2}$CH4(g)+O2(g)=$\frac{1}{2}$CO2(g)+H2O(1);△H=-445kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | ②④ | C. | ③④ | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com