
(12��)�����£���a mol O2��bmol SO2�Ļ������ͨ��һ���̶��ݻ����ܱ������У��������·�Ӧ��
O2 (g) + 2SO2(g)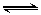 2SO3(g)
2SO3(g)
��һ��������Ӧ��ƽ��ʱ��n (O2) = 4mol��n(SO3) = 4mol,����a��ֵΪ ��
��ƽ��ʱ������ڱ�״��Ϊ313.6L��ԭ���������ƽ��������������ʵ���֮��(д����������ȣ���ͬ)��n(ʼ)��n(ƽ) = ��
�۴ﵽƽ��ʱ��O2��SO2��ת����֮�ȣ���(O2)�æ� (SO2)= ��
����������ʼ��6mol O2��b mol SO2��1 molSO3ͨ���Ϸ�Ӧ�����У���ʼ��Ӧ����������У�ʹ��Ӧ�ﵽƽ��ʱ��������������ʵ���Ϊ12mol����b��ȡֵ��Χ�� ��
��һ����6mol; ��8:7; ��5:6 ������5��b��10
��������
������������ݡ�����ʽ����
O2 (g) + 2SO2(g)  2SO3(g)
2SO3(g)
n��(mol) a b 0
�� n(mol) x 2x 2x
nĩ(mol) 4 b-2x 4
��2x=4 x=2 a-x=4 a=6(mol)
��n(ƽ)=313.6/22.4=14(mol) ����ʽ 4+b-2x+4=14 b=10(mol) ���� n(ʼ)��n(ƽ)=16/14=8/7
���ɡ�����ʽ��֪����(O2)=x/a=2/6=1/3,ͬ���� (SO2)=2/5�����Ԧ�(O2)�æ� (SO2)=5��6
�潫1mol��SO3���С�һ�ߵ�����ת������ѧ����ʽ����࣬�����á�����ʽ�������ֱ����o2��SO2ȫ����Ӧ�����ֱ����bֵ���ɣ������ǿ��淴Ӧ����ȡ�Ⱥţ���
���㣺��ѧƽ���йؼ��㡣


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�����и�����ѧ����ĩ������黯ѧ�Ծ��������棩 ���ͣ�ѡ����
��ȫ������ײʱ������Ӧ��10NaN3+2KNO3=K2O+5Na2O+16N2�� �������ж���ȷ����
A.ÿ����16 mol N2ת��30 mol���� B.NaN3��NԪ�ر���ԭ
C.N2�������������ǻ�ԭ�� D.��ԭ������������������֮��Ϊ1:15
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�����и߶���ѧ�����п��Ի�ѧ�������Ծ��������棩 ���ͣ������
(6��)��ҵ�ϳ�����Ȼ����Ϊ�Ʊ�CH3OH��ԭ�ϡ���֪��
��CH4(g)+O2(g)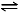 CO(g)+H2(g)+H2O(g) ��H=��321.5 kJ/mol
CO(g)+H2(g)+H2O(g) ��H=��321.5 kJ/mol
��CH4(g)+ H2O(g) 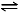 CO(g)+3H2(g) ��H=��250.3 kJ/mol
CO(g)+3H2(g) ��H=��250.3 kJ/mol
��CO(g)+2H2(g) 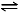 CH3OH(g) ��H=��90.0 kJ/mol
CH3OH(g) ��H=��90.0 kJ/mol
��1��CH4(g)��O2(g)��Ӧ����CH3OH(g)���Ȼ�ѧ����ʽΪ_____________��
��2����V L�����ܱ������г���a mol CO��2a mol H2���ڲ�ͬѹǿ�ºϳɼ״���CO ��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��

��ѹǿP1____P2���������������������
����100�桢P1ѹǿʱ��ƽ�ⳣ��Ϊ________(�ú�a��V�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�����и߶���ѧ�����п��Ի�ѧ�������Ծ��������棩 ���ͣ�ѡ����
���淴Ӧ��X+Y W+Z����Ӧ���ʣ�V����ʱ�䣨t���仯�������ͼ��ʾ��
W+Z����Ӧ���ʣ�V����ʱ�䣨t���仯�������ͼ��ʾ��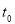 ��ʾ�������������������£��ı���ϵ��һ���������¶ȡ�Ũ�ȡ�ѹǿ��������ı仯�������з�����ȷ����
��ʾ�������������������£��ı���ϵ��һ���������¶ȡ�Ũ�ȡ�ѹǿ��������ı仯�������з�����ȷ����

A��t0ʱ�����ı�����ı仯��ƽ��������Ӧ�����ƶ�
B����t0�ı��������ѹǿ����W��Z��Ϊ���壬X��Y��ֻ��һ��Ϊ����
C����t0�ı���������¶ȣ���÷�Ӧ������Ӧ�����ȷ�Ӧ
D����t0�ı��������Ũ�ȣ��ı�ķ����Ǽ�СX��Y��Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�����и߶���ѧ�����п��Ի�ѧ�������Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A����101kPaʱ��1mol������ȫȼ��ʱ���ų������������������ʵ�ȼ����
B����ͼ���кͷ�Ӧ����1molˮ����ʱ�ķ�Ӧ�Ƚ��к���
C��ȼ���Ȼ��к��ȶ��Ƿ�Ӧ�ȵ�����֮һ
D����������һ��ʱ��������������Ӧ����Һ̬ˮ����̬ˮʱ���ų����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015���ɹ��������и߶���ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����ˮ�������ϸ��¶ȣ�����������ȷ����
A��ˮ�����ӻ����pH��С�������� B��ˮ�����ӻ����䡢pH���䡢������
C��ˮ�����ӻ���С��pH��ʼ��� D��ˮ�����ӻ����pH��С��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015���ɹ��������и߶���ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A����ˮ�ܵ��磬���������ǵ����
B��̼��Ʋ�����ˮ���������Ƿǵ����
C�����������ǵ���ʣ���������������״̬�º�����ˮʱ���ܵ���
D�������䲻�ܵ��磬��������ǿ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015���ɹ��������и߶���ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�������H��0����
A������طֽ������� B��ʵ�������Ȼ�狀����������ư���
C������ʯ��ʯ����ʯ�� D��������NaOH��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�����и�һ��ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ�У�ˮ����ԭ������
A��2Na��2H2O=2NaOH��H2�� B��Cl2��H2O=HCl��HClO
C��2F2��2H2O=4HF��O2 D��SO2��H2O=H2SO3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com