
| A. | 1mol重甲基(-CD3)含有电子数为9NA | |
| B. | 34 g H2O2中含有的阴离子数为NA | |
| C. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| D. | 1 mol铁铝混合物与足量稀盐酸反应时,转移电子数是3NA |
分析 A、重甲基(-CD3)不显电性;
B、依据过氧化氢有少量分子电离,但那是极少数,绝大多数还是以过氧化氢分子形式存在,阴离子只是微量分析;
C、Al3+是弱碱阳离子,在溶液中会水解;
D、1mol铁与稀盐酸反应生成亚铁离子失去2mol电子,1mol铝与稀盐酸反应生成铝离子失去3mol电子,二者失去的电子数不同,无法计算转移的电子数.
解答 解:A、1mol重甲基(-CD3)中含有9mol电子,含有电子数为9NA,故A正确;
B、34gH2O2物质的量为1mol,含有的阴离子为过氧根离子,但过氧化氢是弱电解质,电离程度很少,所以阴离子一定小于1mol,故B错误;
C、由于铝离子部分水解,所以在含Al3+总数为NA的AlCl3溶液中,Cl-总数大于3NA,故C错误;
D、铁与盐酸反应生成的是亚铁离子,铝与盐酸反应生成的是铝离子,所以1mol铁铝混合物与足量盐酸反应失去的电子小于3mol,转移电子数小于3NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2 | B. | CH3CH═CHCH3 | C. | CH3CH═CH2 | D. | CH2═CHCH═CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能越大的原子越容易得到电子 | |
| B. | 同周期元素从左到右第一电离能一定增大 | |
| C. | 同周期元素电负性从左到右越来越大 | |
| D. | 金属元素的电负性一定小于非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的化合价的周期性变化 | |
| B. | 元素原子的原子半径的周期性变化 | |
| C. | 元素原子的核外电子排布的周期性变化 | |
| D. | 元素原子的电子层数的周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
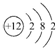 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该元素位于第3周期第ⅡA族 | B. | 该元素位于第2周期第Ⅷ族 | ||
| C. | 该元素位于第2周期第ⅡA族 | D. | 该元素位于第4周期第ⅡB族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原电池是直接把化学能转化为电能的装置.
原电池是直接把化学能转化为电能的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素Q、R、T、W在元素周期表中的位置如图:其中T所处的周期序数与主族序数相等,请回答下列问题
短周期元素Q、R、T、W在元素周期表中的位置如图:其中T所处的周期序数与主族序数相等,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:d>c>b>a | B. | 原子半径:r(A)>r(B)>r(D)>r(C) | ||
| C. | 单质的还原性:A>B>D>C | D. | 离子半径:r(C3-)>r(D-)>r(B+)>r(A2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③④ | C. | ①③④ | D. | ① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com