
| A. | 0.1 mol/L的(NH4)2SO4溶液:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 0.1 mol/L的NaHCO3溶液:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| C. | 将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得溶液:c(Na+)+c(H+)=c(A-)+c(Cl-) | |
| D. | 0.02mol/L CH3COOH溶液和0.01 mol/L NaOH溶液等体积混合所得溶液:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) |
分析 A、硫酸铵是强电解质,能完全电离出铵根离子、硫酸根离子,铵根离子能水解,据此回答;
B、碳酸氢钠溶液中存在物料守恒;
C、将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得溶液是等浓度的NaCl、HA、NaA的混合液,据此回答;
D、0.02mol/L CH3COOH溶液和0.01 mol/L NaOH溶液等体积混合所得溶液是醋酸钠和醋酸的混合物,据此回答.
解答 解:A、硫酸铵是强电解质,能完全电离出铵根离子、硫酸根离子,铵根离子能水解显示酸性,离子浓度关系:c(NH4+)>c(SO42-)>c(H+)>c(OH-),故A错误;
B、碳酸氢钠溶液中存在物料守恒c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),故B错误;
C、将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得溶液是等浓度的NaCl、HA、NaA的混合液,存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-)+c(Cl-),故C错误;
D、0.02mol/L CH3COOH溶液和0.01 mol/L NaOH溶液等体积混合所得溶液是醋酸钠和醋酸的混合物,存在电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),存在物料守恒:2c(Na+)=c(CH3COO-)+c(c(CH3COOH),整理得到:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-),故D正确.
故选D.
点评 本题考查学生离子浓度大小比较方面的知识,注意三大守恒原理的应用是难点,难度不大.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 至少存在5种离子 | |
| B. | Cl-一定存在,且c(Cl-)≥0.2mol/L | |
| C. | SO42-、NH4+、Fe3+一定存在,Al3+、K+、Cl-可能存在 | |
| D. | CO32-一定不存在,SO42-、NH4+、Fe3+、Cl-一定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 稀盐酸滴在石灰石上:CO32-+2H+═CO2↑+H2O | |
| C. | 碳酸氢钠和稀硫酸反应:HCO3-+H+═CO2↑+H2O | |
| D. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
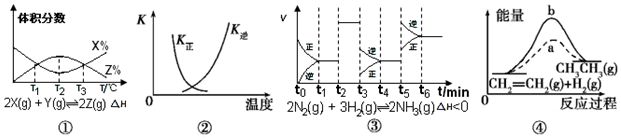
| A. | 由图①知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g),△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 由图③知,反应在t6时,NH3体积分数最大,t3时采取降低反应温度的措施 | |
| D. | 图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用甲苯的硝化反应可以制得TNT炸药 | |
| B. | 苯与甲苯互为同系物,可以用KMnO4酸性溶液进行鉴别 | |
| C. | 苯和溴水振荡后,由于发生化学反应而使溴水的水层颜色变浅 | |
| D. | 煤焦油中含有苯和甲苯,用蒸馏的方法把它们分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 1mol•L-1Mg(NO3)2 溶液 | B. | 5 mL 0.8mol•L-1 Al(NO3)3溶液 | ||
| C. | 10 mL 2mol•L-1AgNO3溶液 | D. | 10 mL 0.5mol•L-1 Cu(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(SO2)=4mol•L-1•min-1 | B. | V(O2)=3mol•L-1•min-1 | ||
| C. | V(SO3)=0.1mol•L-1•S-1 | D. | V(O2)=0.1mol•L-1•S-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com