
【题目】物质A是来自石油的重要有机化工原料,A的产量可以用来衡量一个国家石油化工发展水平。E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。
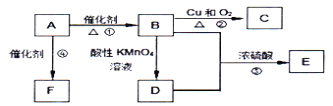
(1)A的结构式为________,F的结构简式为__________。
(2)写出下列反应的反应类型:①________;③_________;
(3)写出反应②的化学方程式____________________;
【答案】![]()
![]() 氧化反应 取代反应或酯化反应 2CH3CH2OH+O2
氧化反应 取代反应或酯化反应 2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
【解析】
由已知,A是来自石油的重要有机化工原料,其产量用来衡量一个国家石油化工发展水平,则A为乙烯;A在催化剂条件发生反应④生成F,F是一种高聚物,可制成多种包装材料,则F为聚乙烯;A(乙烯)在催化剂条件发生反应①生成B,又根据B→C的反应条件可推出B为乙醇、C为乙醛;由B→D的反应条件,结合E是具有果香味的有机物,可推出D为乙酸、E为乙酸乙酯。
(1)由上述分析可知,A的名称为乙烯,其结构式为![]() ;F为聚乙烯, 其结构简式为
;F为聚乙烯, 其结构简式为![]() ;故答案为:
;故答案为:![]() ;
;![]() ;
;
(2)①为A(乙烯)在催化剂条件发生反应生成B,B为乙醇,所以A→B发生了氧化反应;③是B乙醇和D乙酸在浓硫酸的条件下生成E乙酸乙酯的反应,其反应的化学方程式为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应。所以本题答案:氧化反应;取代反应或酯化反应;
CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应。所以本题答案:氧化反应;取代反应或酯化反应;
(3)反应②为乙醇在铜作催化剂的条件下发生氧化反应,其反应的化学方程式2CH3CH2OH+O2![]() 2CH3CHO+2H2O;所以本题答案:2CH3CH2OH+O2
2CH3CHO+2H2O;所以本题答案:2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。


科目:高中化学 来源: 题型:
【题目】下列物质中,能与醋酸发生反应的是( )
①石蕊试液 ②乙醇 ③乙醛 ④金属铝 ⑤氧化镁 ⑥碳酸钠 ⑦氢氧化铜
A.①③④⑤⑥⑦B.②③④⑤C.①②④⑤⑥⑦D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均为C6H6,下列说法正确的是
的分子式均为C6H6,下列说法正确的是
A. b的同分异构体只有d和p两种B. b、d、p的二氯代物均只有三种
C. b、d、p均可与酸性高锰酸钾溶液反应D. b、d、p中只有b的所有原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,无水LiCl-KCl混合物受热熔融后,电池即可瞬间输岀电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法不正确的是

A. 放电时,电子由Ca电极流出
B. 放电时,Li+向PbSO4电极移动
C. 负极反应式:PbSO4+2e-+Li+=Li2SO4+Pb
D. 每转移0.2mol电子,理论上生成还原产物Pb的质量为20.7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯实验装置和步骤如下:
(实验步骤)
取100 mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混合液,将混合酸小心加入B中,把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀,在50~60℃下发生反应,直至反应结束。
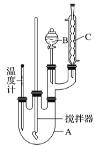
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210 ℃馏分,得到纯硝酸基苯18.00 g。请回答:
(1)装置B的名称是________,装置C的作用是________________。
(2)实验室制备硝基苯的化学方程式是____________________________。
(3)配制混合液时,_____(填“能”或“不能”)将浓硝酸加入到浓硫酸中,说明理由_________。
(4)为了使反应在50~60 ℃下进行,常用的方法是__________。
(5)在洗涤操作中,第二次水洗的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
![]()
(1)为尽量少引入杂质,试剂①应选用___(填标号)。
A.HCl溶液 | B.H2SO4溶液 | C.氨水 | D.NaOH溶液 |
(2)易拉罐溶解过程中主要反应的化学方程式为________。
(3)沉淀B的化学式为________;将少量明矾溶于水,溶液呈弱酸性,其原因是__________。
(4)已知:Kw=1.0×10-14,Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料,常温下可与烧碱溶液发生反应:AlN+NaOH+3H2O=NaAl(OH)4+NH3↑。某课题小组利用甲图所示装置测定样品中AlN的含量(杂质不反应,量气管为碱式滴定管改造)。下列说法正确的是
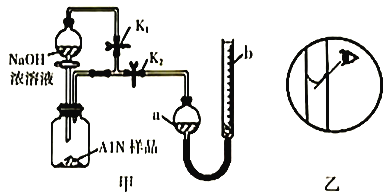
A. 量气管中的液体应为水
B. 用长颈漏斗代替分液漏斗,有利于控制反应速率
C. 反应结束时,a、b两管液面的差值即为产生气体的体积
D. 若其它操作均正确,实验结束时按乙图读数,测得AlN含量偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应或过程需要吸收能量的是( )
A.可燃物的燃烧过程B.手机锂电池充电过程
C.Mg+2HCl=MgCl2+H2↑D.H2SO4+2KOH=K2SO4+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com