
【题目】下列有关实验的操作、现象和结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向浓度均为0.10molL-1的KCl和KI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
B | 向Na2SO3溶液中先加入Ba(NO3)2溶液,然后再加入稀盐酸 | 生成白色沉淀,加入稀 盐酸,沉淀不溶解 |
|
C | 向盛有NH4Al(SO4)2溶液的试管中,滴加少量NaOH溶液 | 产生使湿润的红色石蕊试纸变蓝的气体 | NH4++OH- = NH3↑+H2O |
D | 测定等物质的量浓度的Na2CO3和NaClO的pH值 | Na2CO3>NaClO | 酸性:H2CO3<HClO |
A.AB.BC.CD.D
【答案】A
【解析】
A.向浓度均为0.10molL-1的KCl和KI混合溶液中滴加少量AgNO3溶液,出现黄色沉淀,说明相同条件下AgI先于AgCl沉淀,二者为同种类型沉淀,Ksp越小溶解度越小,相同条件下越先沉淀,所以Ksp(AgCl)>Ksp(AgI),故A正确;
B.即便亚硫酸没有变质,先加入Ba(NO3)2溶液,再加入稀盐酸后硝酸根也会将亚硫酸根氧化沉硫酸根,故B错误;
C.向盛有NH4Al(SO4)2溶液的试管中,滴加少量NaOH溶液会先发生Al3++3OH-=Al(OH)3↓,并不能生成氨气,故C错误;
D.测定等物质的量浓度的Na2CO3和NaClO的pH值,Na2CO3>NaClO可以说明HCO3-的酸性强于HClO,若要比较H2CO3和HClO的酸性强弱,需要测定等物质的量浓度NaHCO3和NaClO的pH值,故D错误;
故答案为A。


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是( )

A. S2Cl2的结构式为Cl-S-S-Cl
B. S2Cl2为含有极性键和非极性键的非极性分子
C. S2Br2与S2Cl2结构相似,分子间作用力:S2Br2>S2Cl2
D. S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年国际非政府组织“全球碳计划”12月4日发布报告:研究显示,全球二氧化碳排放量增速趋于缓。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是将CO2转化为成为有机物实现碳循环。如:
C2H4 (g) + H2O (l) = C2H5OH (l) ΔH=-44.2 kJ·mol-1
2CO2(g) + 2H2O (l) =C2H4 (g) +3O2(g) ΔH=+1411.0 kJ·mol-1
2CO2(g) + 3H2O (l) = C2H5OH (l) + 3O2(g) ΔH=___________
(2)CO2甲烷化反应是由法国化学家Paul Sabatier 提出的,因此,该反应又叫Sabatier反应。CO2催化氢化制甲烷的研究过程:
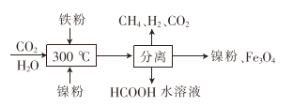
①上述过程中,产生H2反应的化学方程式为:___________________________________。
②HCOOH是CO2转化为CH4的中间体:CO2 ![]() HCOOH
HCOOH ![]() CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉的用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是_______________(填I或II)
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉的用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是_______________(填I或II)
(3)CO2经催化加氢可以生成低碳烃,主要有两个竞争反应:
反应I:CO2(g) + 4H2 (g)![]() CH4 (g) +2H2O(g)
CH4 (g) +2H2O(g)
反应II:2CO2(g) + 6H2 (g)![]() C2H4 (g) +4H2O(g)
C2H4 (g) +4H2O(g)
在1L密闭容器中冲入1molCO2和4molH2,测得平衡时有关物质的物质的量随温度变化如图所示。T1℃时,CO2的转化率为_________。T1℃时,反应I的平衡常数K=_______。

(4)已知CO2催化加氢合成乙醇的反应原理为2CO2(g) + 6H2 (g)![]() C2H5OH (g) +4H2O(g) ΔH,m代表起始时的投料比,即m=
C2H5OH (g) +4H2O(g) ΔH,m代表起始时的投料比,即m=![]() .
.
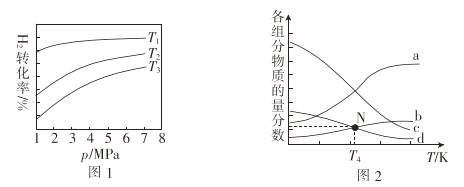
①图1中投料比相同,温度T3>T2>T1,则ΔH_____(填“>”或“<”)0.
②m=3时,该反应达到平衡状态后p(总)=20ɑ MPa ,恒压条件下各物质的物质的量分数与温度的关系如图2.则曲线b代表的物质为_______(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铜阳极泥(主要成分是Cu2Te,含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:
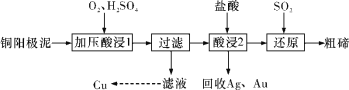
已知:TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。下列说法错误的是
A.“加压酸浸1”过程中将碲元素转化成TeO2,应严格控制溶液的pH值
B.“酸浸2”过程中温度不能过高,否则会使碲的浸出率降低
C.从Ag和Au中分离出Au,应该向回收的Ag和Au中加入稀氨水
D.“还原”反应中发生的离子方程式为:TeO2+2SO2+2H2O=Te+2SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B都是短周期元素,原子最外层电子排布式分别为![]() 。A与B可形成化合物C和D。D溶于水时有气体逸出,该气体能使带火星的木条复燃。请回答下列问题。
。A与B可形成化合物C和D。D溶于水时有气体逸出,该气体能使带火星的木条复燃。请回答下列问题。
(1)比较电离能:
①![]() _____
_____ ![]() (填“>”或“<”,下同)
(填“>”或“<”,下同)
②![]() _____
_____ ![]() 。
。
(2)通常A元素的化合价是 _____________ ,对A元素呈现这种价态进行解释:
①用原子结构的观点进行解释:_____________ 。
②用电离能的观点进行解释:______________ 。
(3)写出D跟水反应的离子方程式: _________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒容的条件下对于N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为
2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为
A.断开一个N≡N键的同时有6个N—H键生成
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.N2、H2、NH3分子数之比为1∶3∶2的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

已知:①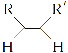
![]() RCHO+R′CHO
RCHO+R′CHO
②RCHO+R′CH2CHO![]()
![]() +H2O
+H2O
③![]()
请回答下列问题:
(1)芳香族化合物B的名称为________,1molB最多能与_____molH2加成,其加成产物等效氢共有_______种。
(2)由E生成F的反应类型为________,F分子中所含官能团的名称是_______。
(3)X的结构简式为________。
(4)写出D生成E的第①步反应的化学方程式______。
(5)G与乙醇发生酯化反应生成化合物Y,Y有多种同分异构体,其中符合下列条件的同分异构体有________种,写出其中任意一种的结构简式____。
①分子中含有苯环,且能与饱和碳酸氢钠溶液反应放出CO2;②其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1。
(6)根据题目所给信息,设计由乙醛和苯甲醛制备![]() 的合成路线(无机试剂任选)______。
的合成路线(无机试剂任选)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,H2CO3的Ka1=4.2×10-7,Ka2=5.0×10-11。常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入40mL0.1mol/L'HCl溶液,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
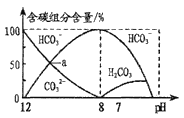
下列说法正确的是
A. 在同一溶液中,H2CO3、HCO3-、CO32-能大量共存
B. a点时:c(Na+)+c(H+)=c(OH-)+3c(CO32-)
C. 当pH=7时,溶液中c(Na+)=c(HCO3-)+2c(CO32-)
D. 当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】线型 PAA( ![]() )具有高吸水性,网状 PAA 在抗压性、吸水性等方面优于线型 PAA。网状 PAA 的制备方法是:将丙烯酸用 NaOH 中和,加入少量交联剂 a,再引发聚合。其部分结构片段 如图所示,列说法错误的是
)具有高吸水性,网状 PAA 在抗压性、吸水性等方面优于线型 PAA。网状 PAA 的制备方法是:将丙烯酸用 NaOH 中和,加入少量交联剂 a,再引发聚合。其部分结构片段 如图所示,列说法错误的是
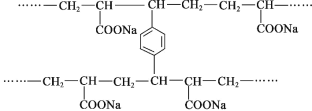
A.线型 PAA 的单体不存在顺反异构现象
B.形成网状结构的过程发生了加聚反应
C.交联剂 a 的结构简式是![]()
D.PAA 的高吸水性与—COONa 有关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com