
A、B、C、D、E、F六种元素的原子序数依次递增。已知:
①F的原子序数为29,其余的均为短周期主族元素;②E原子价电子(外围电子)排布为msnmpn-1;③D原子最外层电子数为偶数;④A、C原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)下列叙述正确的是________(填序号)。
A.金属键的强弱:D>E
B.基态原子第一电离能:D>E
C.五种元素中,电负性最大的元素是E
D.晶格能:NaCl<DCl2
(2)F基态原子的核外电子排布式为________;与F同一周期的副族元素的基态原子中最外层电子数与F原子相同的元素为________(填元素符号)。
(3)A与C形成的非极性分子中,σ键与π键的个数之比为________;该分子与过量强碱反应生成的酸根离子的空间构型为________。
(4)已知原子数和价电子数相同的分子或离子为等电子体,互为等电子体的微粒结构相同,B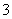 中心原子的杂化轨道类型为________。
中心原子的杂化轨道类型为________。
解析 s轨道最多排2个电子,故E的最外层电子数为3,根据A、C原子p轨道的电子数分别为2和4,可得A、C、E分别为ⅣA、ⅥA、ⅢA族的元素,结合原子序数依次增大,可知A、B、C、D、E分别是碳、氮、氧、镁、铝,由F的原子序数为29知F
是铜。
(1)离子半径Al3+<Mg2+,形成的金属键Al强于Mg,Mg的第一电离能大于Al的,故A项错误,B项正确;这五种元素中,电负性最大的是C(氧),C项错误。
(2)注意铜的核外电子排布式符合“轨道全满、半满稳定”的原则,故Cu基态原子的核外电子排布式为“1s22s22p63s23p63d104s1”,而不是“1s22s22p63s23p63d94s2”。
(3)CO2分子中σ键有两个、π键有两个,CO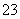 为平面三角形。
为平面三角形。
(4)N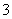 与CO2为等电子体,也为直线形分子,故中心原子为sp杂化。
与CO2为等电子体,也为直线形分子,故中心原子为sp杂化。
答案 (1)BD (2)1s22s22p63s23p63d104s1 Cr (3)1∶1 平面三角形 (4)sp杂化


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废
铜粉制备硫酸铜晶体。生产过程如下:
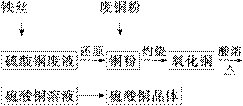 |
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有_____________________。
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因可能是:
①灼烧不充分Cu未被完全氧化。
②CuO被还原。还原剂可能是________,该反应的化学方程式是______________
________________________________________________________________________。
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示)____________________。
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是__________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,有下列四种溶液:
| ① | ② | ③ | ④ |
| 0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
下列说法中正确的是( )
A.①稀释到原来的100倍后,pH与②相同
B.等体积①③混合、等体积②④混合所得的溶液都呈酸性
C.①②中分别加入少量CH3COONa固体,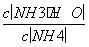 的值都变小
的值都变小
D.③④稀释到原来的100倍后,稀释后④溶液中的pH大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组原子中,彼此化学性质一定相似的是( )
A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2p轨道上只有2个电子的X原子与3p轨道上只有2个电子的Y 原子
原子
D.最 外层都只有一个电子的X、Y原子
外层都只有一个电子的X、Y原子
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学设计了钠与氯气反应的装置,如下图所示。将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,直到钠熔融成圆球时,停止加热,通入氯气,即可见钠燃烧起来,产生大量白烟。下面的有关叙述错误的是( )
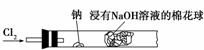
A.钠燃烧产生苍白色火焰
B.浸有NaOH溶液的棉花球是用于吸收过量的氯气,以避免污染空气
C.反应产生的大量白烟是氯化钠晶体
D.若在棉花球外沿滴一滴淀粉碘化钾溶液,可以判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组同学以碳棒为电极电解CuCl2溶液时,发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出。为探究阴极碳棒上的产物,同学们设计了如下实验过程。
(1)对比实验(以碳棒为电极电解下列溶液)
| 电解质溶液 | 阴极析出物质 | |
| 实验1 | CuSO4溶液 | 红色固体 |
| 实验2 | CuSO4和NaCl的混合溶液 | 红色固体和少量白色固体 |
(2)提出假设
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为________。
(3)实验验证
取电解CuCl2溶液后的阴极碳棒,洗涤、干燥。连接下列装置进行实验,验证阴极产物。
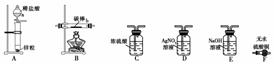
仪器a的名称为________,各装置从左至右的连接顺序为________。
(4)观察现象,得出结论
实验结束后,碳棒上的白色物质变为红色,F中物质不变色,D中出现白色沉淀。
根据现象写出装置B中发生反应的化学方程式:
________________________________________________________________________。
(5)问题讨论
①欲洗去碳棒上的红色和白色物质,可将碳棒插入稀硝酸中,则红色物质消失的离子方程式为______________________;白色物质消失的离子方程式为_________________
______________________。
②实验过程中,若装置B中的空气没有排净就开始加热,可能对实验造成的影响是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,颜色的变化与氧化还原反应有关的是( )
A.往紫色石蕊溶液中加入盐酸,溶液变红
B.饱和FeCl3溶液在沸水中变成红褐色胶体
C.向FeSO4溶液中滴加NaOH溶液,生成的沉淀由白色变成灰绿色,最后变成红褐色
D.SO2使滴有酚酞的NaOH溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com