
 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:解答题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图为实验室制取乙酸乙酯的装置.
如图为实验室制取乙酸乙酯的装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向移动了 | B. | 物质A的转化率减少了 | ||
| C. | 物质B的质量分数减小了 | D. | m 小于n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
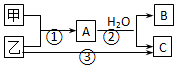
| A. | 若C为酸性气体,则B可能具有两性 | |
| B. | 若C是碱性气体,则B一定是碱 | |
| C. | 若B、C是两种酸,则B、C一定都是一元酸 | |
| D. | 以上3个转变可能都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验操作 | 预期现象 | 结论 |
| 实验1:在试管A加入少量乙醚,充分振荡,静置 | 乙醚层呈红色 | “猜想一”不成立 |
| 实验2:取萃取后的上层清液滴加2-3滴 K4[Fe(CN)6]溶液 | 若产生蓝色沉淀 | 则“猜想二”成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖和麦芽糖均能发生水解反应和银镜反应 | |
| B. | 植物油可用于萃取碘水中的碘 | |
| C. | 面粉、牛油、丝绸完全燃烧都只生成CO2和H2O | |
| D. | 用渗析的方法不能对鸡蛋白和淀粉的混合溶液进行分离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com