
(12��)�ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����塣��ԭ��Ϊ��
N2(g)+3H2(g) 2NH3(g) ��H= -92.4KJ/mol ���ݴ˻ش��������⣺
��1�������йظ÷�Ӧ���ʵ���������ȷ���ǣ�ѡ����ţ� ��
a�������¶ȿ����������Ӱٷ������ӿ췴Ӧ����
b������ѹǿ�����������Ӱٷ��������Բ����Լӿ췴Ӧ����
c��ʹ�ô�������ʹ��Ӧ�����ƽ���������ߣ��ӿ췴Ӧ����
d��������һ��������£����������ı������С���Է�Ӧ����������Ӱ��
��2���ٸ÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=_______________________��
�ڸ����¶ȶԻ�ѧƽ���Ӱ����ɿ�֪�����ڸ÷�Ӧ���¶�Խ�ߣ���ƽ�ⳣ����ֵԽ_____ ��
��3��ij�¶��£�����10 mol N2��30 mol H2 �������Ϊ10 L���ܱ������ڣ���Ӧ�ﵽƽ��״̬ʱ�����ƽ���������а����������Ϊ20%������¶��·�Ӧ��K=___________�����÷�����ʾ������˵���÷�Ӧ�ﵽ��ѧƽ��״̬���� ������ĸ����
a�������ڵ��ܶȱ��ֲ��� b��������ѹǿ���ֲ���
c��������N2����2������NH3�� d����������� c��NH3������
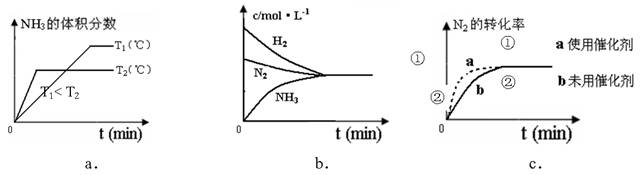
��4�����ںϳɰ���Ӧ���ԣ������й�ͼ��һ����ȷ���ǣ�ѡ����ţ�_____________��
��5����ͬ�¶��£��к����ܱ�����A�ͺ�ѹ�ܱ�����B���������о�����1molN2��3 molH2����ʱ�������������ȡ���һ�������·�Ӧ�ﵽƽ��״̬��A��NH3���������Ϊa���ų�����Q1kJ��
B��NH3���������Ϊb���ų�����Q2kJ����a_____b(��>��=��<)�� Q1_____Q2(��>��=��<)�� Q1_____92.4(��>��=��<)��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2010�걱�����и߶���ѧ����ĩ���Ի�ѧ���� ���ͣ������
(12��)�ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����塣��ԭ��Ϊ��
N2(g)+3H2(g)  2NH3(g) ��H=" -92.4KJ/mol " ���ݴ˻ش��������⣺
2NH3(g) ��H=" -92.4KJ/mol " ���ݴ˻ش��������⣺
��1�������йظ÷�Ӧ���ʵ���������ȷ���ǣ�ѡ����ţ� ��
a�������¶ȿ����������Ӱٷ������ӿ췴Ӧ����
b������ѹǿ�����������Ӱٷ��������Բ����Լӿ췴Ӧ����
c��ʹ�ô�������ʹ��Ӧ�����ƽ���������ߣ��ӿ췴Ӧ����
d��������һ��������£����������ı������С���Է�Ӧ����������Ӱ��
��2���ٸ÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=_______________________��
�ڸ����¶ȶԻ�ѧƽ���Ӱ����ɿ�֪�����ڸ÷�Ӧ���¶�Խ�ߣ���ƽ�ⳣ����ֵԽ_____ ��
��3��ij�¶��£�����10 mol N2��30 mol H2�������Ϊ10 L���ܱ������ڣ���Ӧ�ﵽƽ��״̬ʱ�����ƽ���������а����������Ϊ20%������¶��·�Ӧ��K=___________�����÷�����ʾ������˵���÷�Ӧ�ﵽ��ѧƽ��״̬���� ������ĸ����
a�������ڵ��ܶȱ��ֲ��� b��������ѹǿ���ֲ���
c��������N2����2������NH3�� d�����������c��NH3������
��4�����ںϳɰ���Ӧ���ԣ������й�ͼ��һ����ȷ���ǣ�ѡ����ţ�_____________��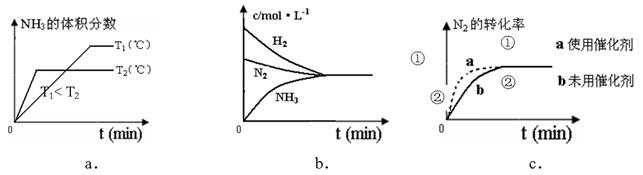
��5����ͬ�¶��£��к����ܱ�����A�ͺ�ѹ�ܱ�����B���������о�����1mol N2��3 molH2����ʱ�������������ȡ���һ�������·�Ӧ�ﵽƽ��״̬��A��NH3���������Ϊa���ų�����Q1 kJ��
B��NH3���������Ϊb���ų�����Q2 kJ����a_____b(��>��=��<)�� Q1_____ Q2(��>��=��<)�� Q1_____92.4(��>��=��<)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�꽭��ʡ������ѧ�ڵ������¿���ѧ�Ծ����գ� ���ͣ������
(12��)�ϳɰ��Ի�ѧ��ҵ������ҵ������Ҫ���塣
����ϳ����а����ʵ���֮��l��4����N2��H2���а��ĺϳɣ�ͼAΪT��ʱƽ�������а��������������ѹǿ(p)�Ĺ�ϵͼ��
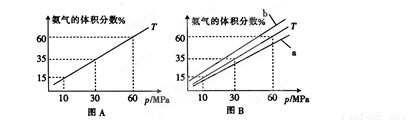
��ͼA�а������������Ϊ15��ʱ��H2��ת����Ϊ ��
��ͼB��T=500�棬���¶�Ϊ450��ʱ��Ӧ�������� (�a����b��)��
�ƺϳɰ�������������ɼ�����ˮ��Ӧ�Ƶã���Ӧ���Ȼ�ѧ����ʽΪCH4(g)+H2O(g)
 CO(g)+3H2(g) ��H>0��һ���¶��£������Ϊ2 L�ĺ��������з���������Ӧ�������ʵ����ʵ����仯���±���
CO(g)+3H2(g) ��H>0��һ���¶��£������Ϊ2 L�ĺ��������з���������Ӧ�������ʵ����ʵ����仯���±���
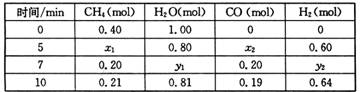
�ٷ����������ݣ��ж�5 minʱ��Ӧ�Ƿ���ƽ��״̬? (��ǡ���)��
ǰ5 min��Ӧ��ƽ����Ӧ����v(CH4)= ��
�ڸ��¶��£�������Ӧ��ƽ�ⳣ��K= ��
�۷�Ӧ��7~10 min�ڣ�CO�����ʵ������ٵ�ԭ������� (����ĸ)��
a������CH4�����ʵ��� b�������¶� c�������¶� d������H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�걱�����и߶���ѧ����ĩ���Ի�ѧ���� ���ͣ������
(12��)�ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����塣��ԭ��Ϊ��
N2(g)+3H2(g)  2NH3(g) ��H= -92.4KJ/mol ���ݴ˻ش��������⣺
2NH3(g) ��H= -92.4KJ/mol ���ݴ˻ش��������⣺
��1�������йظ÷�Ӧ���ʵ���������ȷ���ǣ�ѡ����ţ� ��
a�������¶ȿ����������Ӱٷ������ӿ췴Ӧ����
b������ѹǿ�����������Ӱٷ��������Բ����Լӿ췴Ӧ����
c��ʹ�ô�������ʹ��Ӧ�����ƽ���������ߣ��ӿ췴Ӧ����
d��������һ��������£����������ı������С���Է�Ӧ����������Ӱ��
��2���ٸ÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=_______________________��
�ڸ����¶ȶԻ�ѧƽ���Ӱ����ɿ�֪�����ڸ÷�Ӧ���¶�Խ�ߣ���ƽ�ⳣ����ֵԽ_____ ��
��3��ij�¶��£�����10 mol N2��30 mol H2 �������Ϊ10 L���ܱ������ڣ���Ӧ�ﵽƽ��״̬ʱ�����ƽ���������а����������Ϊ20%������¶��·�Ӧ��K=___________�����÷�����ʾ������˵���÷�Ӧ�ﵽ��ѧƽ��״̬���� ������ĸ����
a�������ڵ��ܶȱ��ֲ��� b��������ѹǿ���ֲ���
c��������N2����2������NH3�� d����������� c��NH3������
��4�����ںϳɰ���Ӧ���ԣ������й�ͼ��һ����ȷ���ǣ�ѡ����ţ�_____________��
��5����ͬ�¶��£��к����ܱ�����A�ͺ�ѹ�ܱ�����B���������о�����1mol N2��3 molH2����ʱ�������������ȡ���һ�������·�Ӧ�ﵽƽ��״̬��A��NH3���������Ϊa���ų�����Q1 kJ��
B��NH3���������Ϊb���ų�����Q2 kJ����a_____b(��>��=��<)�� Q1_____ Q2(��>��=��<)�� Q1_____92.4(��>��=��<)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(12��)�ϳɰ��Ի�ѧ��ҵ������ҵ������Ҫ���塣
����ϳ����а����ʵ���֮��l��4����N2��H2���а��ĺϳɣ�ͼAΪT��ʱƽ�������а��������������ѹǿ(p)�Ĺ�ϵͼ��
��ͼA�а������������Ϊ15��ʱ��H2��ת����Ϊ ��
��ͼB��T=500�棬���¶�Ϊ450��ʱ��Ӧ�������� (�a����b��)��
�ƺϳɰ�������������ɼ�����ˮ��Ӧ�Ƶã���Ӧ���Ȼ�ѧ����ʽΪCH4(g)+H2O(g)
CO(g)+3H2(g) ��H>0��һ���¶��£������Ϊ2 L�ĺ��������з���������Ӧ�������ʵ����ʵ����仯���±���
�ٷ����������ݣ��ж�5 minʱ��Ӧ�Ƿ���ƽ��״̬? (��ǡ���)��
ǰ5 min��Ӧ��ƽ����Ӧ����v(CH4)= ��
�ڸ��¶��£�������Ӧ��ƽ�ⳣ��K= ��
�۷�Ӧ��7~10 min�ڣ�CO�����ʵ������ٵ�ԭ������� (����ĸ)��
a������CH4�����ʵ��� b�������¶� c�������¶� d������H2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com