
【题目】工业上用蚀刻液浸泡铜板可制备印刷电路板,产生的蚀刻废液需要回收利用。
(1)应用传统蚀刻液(HCl-FeCl3)
①蚀刻铜板主要反应的离子方程式为________。
②该蚀刻液中加入一定量盐酸的目的为________,同时提高蚀刻速率。
③FeCl3型酸性废液处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+2Fe3+ ![]() 3Fe2+、Fe+Cu2+
3Fe2+、Fe+Cu2+ ![]() Fe2++Cu,还有________、________。(用离子方程式表示)。
Fe2++Cu,还有________、________。(用离子方程式表示)。
(2)应用酸性蚀刻液(HCl-H2O2),产生的蚀刻废液处理方法如下:
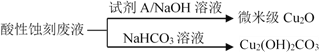
①蚀刻铜板主要反应的离子方程式为________。
②回收微米级Cu2O过程中,加入的试剂A是______(填字母)。
a.Fe粉 b.葡萄糖 c. NaCl固体 d.酸性KMnO4溶液
③回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是________。
(3)应用碱性蚀刻液(NH3H2O–NH4Cl) 蚀刻铜板,会有Cu(NH3)4Cl2和水生成。蚀刻铜板主要反应的化学方程式为________。
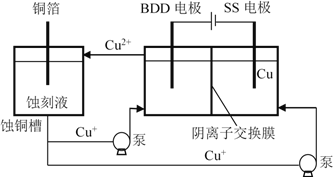
(4)与常规方法不同,有研究者用HCl-CuCl2做蚀刻液。蚀铜结束,会产生大量含Cu+废液,采用如图所示方法,可达到蚀刻液再生、回收金属铜的目的。此法采用掺硼的人造钻石BDD电极,可直接从水中形成一种具有强氧化性的氢氧自由基(HO),进一步反应实现蚀刻液再生,结合化学用语解释CuCl2蚀刻液再生的原理________。
【答案】 2 Fe3++ Cu ![]() 2Fe2+ +Cu2+ 抑制FeCl3水解 Fe+2H+
2Fe2+ +Cu2+ 抑制FeCl3水解 Fe+2H+ ![]() Fe2++H2↑ 2Fe2+ + Cl2
Fe2++H2↑ 2Fe2+ + Cl2 ![]() 2Fe3++ 2Cl- Cu + 2H+ + H2O2
2Fe3++ 2Cl- Cu + 2H+ + H2O2 ![]() Cu2+ + 2H2O b 温度高于80℃时,Cu2(OH)2CO3易分解生成黑色CuO,导致产品颜色发暗 2Cu + 4NH4Cl + 4NH3H2O + O2
Cu2+ + 2H2O b 温度高于80℃时,Cu2(OH)2CO3易分解生成黑色CuO,导致产品颜色发暗 2Cu + 4NH4Cl + 4NH3H2O + O2 ![]() 2Cu(NH3)4Cl2 + 6H2O 在阳极发生反应H2O – e–
2Cu(NH3)4Cl2 + 6H2O 在阳极发生反应H2O – e– ![]() HO + H+ ,H+ + Cu+ + OH
HO + H+ ,H+ + Cu+ + OH ![]() Cu2+ + H2O生成Cu2+,Cl-通过阴离子交换膜移入阳极区, CuCl2蚀刻液再生
Cu2+ + H2O生成Cu2+,Cl-通过阴离子交换膜移入阳极区, CuCl2蚀刻液再生
【解析】(1)应用传统蚀刻液(HCl-FeCl3),①Fe3+具有氧化性,蚀刻铜板主要反应铁离子将铜氧化,离子方程式为2 Fe3++ Cu ![]() 2Fe2+ +Cu2+。②该蚀刻液中加入一定量盐酸的目的为抑制FeCl3水解,同时提高蚀刻速率。③FeCl3型酸性废液处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+2Fe3+
2Fe2+ +Cu2+。②该蚀刻液中加入一定量盐酸的目的为抑制FeCl3水解,同时提高蚀刻速率。③FeCl3型酸性废液处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+2Fe3+ ![]() 3Fe2+、Fe+Cu2+
3Fe2+、Fe+Cu2+ ![]() Fe2++Cu,还有Fe+2H+ = Fe2++H2↑和 2Fe2+ + Cl2 = 2Fe3++ 2Cl-。(2)①H2O2在酸性条件下具有强氧化性,可氧化Cu生成CuCl2,蚀刻铜板主要反应的离子方程式为Cu + 2H+ + H2O2
Fe2++Cu,还有Fe+2H+ = Fe2++H2↑和 2Fe2+ + Cl2 = 2Fe3++ 2Cl-。(2)①H2O2在酸性条件下具有强氧化性,可氧化Cu生成CuCl2,蚀刻铜板主要反应的离子方程式为Cu + 2H+ + H2O2 ![]() Cu2+ + 2H2O。②HCl-H2O2型蚀刻液含有Cu2+,在碱性条件下生成Cu(OH)2,可与弱还原剂生成Cu2O,选项中葡萄糖资源广,无害,最合适,回收微米级Cu2O过程中,加入的试剂A是b.葡萄糖。③回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是:温度高于80℃时,Cu2(OH)2CO3易分解生成黑色CuO,导致产品颜色发暗。(3)应用碱性蚀刻液(NH3H2O–NH4Cl) 蚀刻铜板,会有Cu(NH3)4Cl2和水生成。Cu2+易与NH3发生反应生成配合物Cu(NH3)4Cl2,蚀刻铜板主要反应的化学方程式为 2Cu + 4NH4Cl + 4NH3H2O + O2
Cu2+ + 2H2O。②HCl-H2O2型蚀刻液含有Cu2+,在碱性条件下生成Cu(OH)2,可与弱还原剂生成Cu2O,选项中葡萄糖资源广,无害,最合适,回收微米级Cu2O过程中,加入的试剂A是b.葡萄糖。③回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是:温度高于80℃时,Cu2(OH)2CO3易分解生成黑色CuO,导致产品颜色发暗。(3)应用碱性蚀刻液(NH3H2O–NH4Cl) 蚀刻铜板,会有Cu(NH3)4Cl2和水生成。Cu2+易与NH3发生反应生成配合物Cu(NH3)4Cl2,蚀刻铜板主要反应的化学方程式为 2Cu + 4NH4Cl + 4NH3H2O + O2 ![]() 2CuNH3)4Cl2 + 6H2O。(4)在阳极发生反应H2O – e–
2CuNH3)4Cl2 + 6H2O。(4)在阳极发生反应H2O – e– ![]() HO + H+ ,H+ + Cu+ + OH
HO + H+ ,H+ + Cu+ + OH ![]() Cu2+ + H2O生成Cu2+,Cl-通过阴离子交换膜移入阳极区, CuCl2蚀刻液再生。
Cu2+ + H2O生成Cu2+,Cl-通过阴离子交换膜移入阳极区, CuCl2蚀刻液再生。


科目:高中化学 来源: 题型:
【题目】在一个不导热的密闭反应器中,只发生两个反应:A(g)+B(g)![]() 2C(g) △H < 0
2C(g) △H < 0
X(g)+3Y(g)![]() 2Z(g) △H > 0,进行相关操作且达到平衡,下列叙述正确的是
2Z(g) △H > 0,进行相关操作且达到平衡,下列叙述正确的是
A. 等压时,通入惰性气体,C的物质的量增大
B. 等压时,通入X气体,反应器中温度不变
C. 等容时,通入惰性气体,各反应速率不变
D. 等容时,通入X气体,Y的物质的量浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 用Na2S处理含Hg2+废水:Hg2+ + S2 = HgS↓
B. 燃煤中添加生石灰减少SO2的排放:2CaO + O2 + 2SO2 ![]() 2CaSO4
2CaSO4
C. 工业上将Cl2 通入石灰乳中制漂白粉:Cl2 + OH- = Cl-+ ClO- + H2O
D. 向漂白液中加入适量洁厕灵(含盐酸),产生氯气:ClO-+ Cl-+2H+ = Cl2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可从铅蓄电池中回收铅,实现铅的再生。在工艺中得到含Na2PbCl4的电解液,电解Na2PbCl4溶液后生成Pb,如图所示。下列说法不正确的是

A. 阳极区会有气泡冒出,产生O2
B. 一段时间后,阳极附近pH明显增大
C. 阴极的电极反应方程式为PbCl42+ 2e ![]() Pb + 4Cl-
Pb + 4Cl-
D. Na2PbCl4浓度下降后可在阴极区加入PbO,实现电解液的继续使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质的分类、名称(或俗名)、化学式都正确的是( )
A.酸性氧化物 干冰 CO2
B.碱 纯碱 Na2CO3
C.酸 硫酸 H2SO3
D.单质 氯水 Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究过量甲醛与新制氢氧化铜的反应,探究过程如下:
(一)提出猜想
(1)甲同学通过查阅资料,提出猜想1和猜想2。
猜想1:HCHO + Cu(OH)2![]() Cu + CO↑+ 2H2O
Cu + CO↑+ 2H2O
猜想2:HCHO + 4Cu(OH)2 + 2NaOH![]() 2Cu2O + Na2CO3 + 6H2O
2Cu2O + Na2CO3 + 6H2O
猜想1和猜想2均体现了甲醛的________性。
(2)乙同学类比乙醛与新制氢氧化铜的反应,提出猜想3。
用化学方程式表示猜想3:________。
(二)进行实验,收集证据
已知:可用银氨溶液检测CO,反应为CO + 2Ag(NH3)2OH ![]() 2Ag↓+ (NH4)2CO3 + 2NH3。实验在如下装置中进行。反应结束后,A中生成紫红色固体沉淀物,C中银氨溶液无明显变化,气囊略鼓起。
2Ag↓+ (NH4)2CO3 + 2NH3。实验在如下装置中进行。反应结束后,A中生成紫红色固体沉淀物,C中银氨溶液无明显变化,气囊略鼓起。
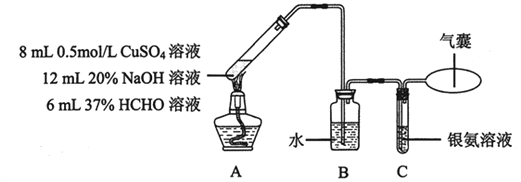
(3)配制银氨溶液所需的试剂是________。
(4)装置B中水的作用是________。
(5)甲同学取A中反应后溶液加入到足量稀盐酸中,无明显现象。乙同学另取该溶液加入到BaCl2溶液中,产生大量白色沉淀。
实验方案明显不合理的是________(填“甲”或“乙”),理由是________。
(6)已知Cu2O![]() Cu + CuSO4。
Cu + CuSO4。
丙同学通过实验证明生成的紫红色固体沉淀物是Cu,其实验方案为________。
(三)得出结论
(7)写出过量甲醛与新制氢氧化铜可能发生反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中不同的化学键如图,关于乙醇在各种反应中断裂键的说法不正确的是( )

A. 乙醇和钠反应,键①断裂
B. 在Ag催化下和O2反应,键①③断裂
C. 乙醇和浓H2SO4共热140℃时,键①或键②断裂;在170℃时,键②⑤断裂
D. 乙醇完全燃烧时断裂键①②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com