

分析 (1)依据元素化合价的变化分析,氮元素化合价-3价和+3价变化为0价,结合电子守恒和原子守恒配平书写化学方程式;
(2)依据氧化剂和还原剂概念结合化学方程式中的定量关系计算;
(3)依据图象变化特征分析,先拐先平,温度高,压强大,t1>t2,温度越高A%越小,说明升温平衡正向进行,正反应为吸热反应,P1<P2,压强越大A的转化率越小,说明增大压强平衡逆向进行,逆向为气体体积减小的反应.
解答 解:(1)氮元素化合价-3价和+3价变化为0价,电子转移为3,结合电子守恒和原子守恒配平书写化学方程式8NH3+6NO2-=7N2+12H2O,
故答案为:8、6、7、12;
(2)8NH3+6NO2-=7N2+12H2O反应中,氧化剂为NO2-,氧化产物为N2,还原剂为NH3被氧化为N2,氧化产物与还原产物的质量比为8:6=4:3,
故答案为:4:3;
(3)图象变化特征分析,先拐先平温度高,t1>t2,温度越高A的含量越小,说明升温平衡正向进行,正反应为吸热反应,△H>0,先拐先平压强大P1<P2,压强越大A的转化率越小,说明增大压强平衡逆向进行,逆向为气体体积减小的反应,a+b<c+d,
故答案为:正值、小、小、高、正.
点评 本题考查了化学平衡影响因素的分析判断,图象分析方法,氧化还原反应产物的理解应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
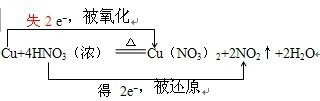 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 回收电池中的石墨电极 | |
| B. | 回收电池外壳金属材料 | |
| C. | 防止电池中汞、镉、铜等重金属对土壤和水源的污染 | |
| D. | 防止电池中的渗出液腐蚀其它物品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Na+、H+、SO42- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | Ba2+、Na+、OH-、NO3- | D. | Na+、Mg2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Fe是正极,Pt是负极 | B. | 该装置中,电子从Fe流向Pt | ||
| C. | 正极反应为:2H++2e-═H2↑ | D. | 负极反应为:4OH--4e-═2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10.0g | B. | 15.0g | C. | 16.7g | D. | 18.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

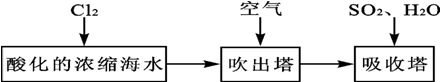

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com