


科目:高中化学 来源: 题型:阅读理解
| 充电 |
| 放电 |
| ||
| 高温高压 |
| 时间/min | c(N2)/mol?L-1 | c(H2)/mol?L-1 | c(NH3)/mol?L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省南安市侨光中学高二上学期期末考试化学试卷 题型:实验题
如图所示3套实验装置,分别回答下列问题。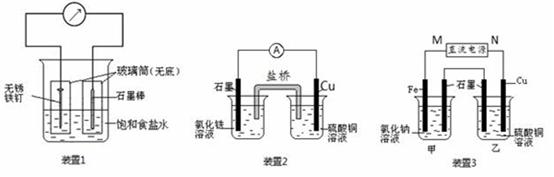
(1)装置1为铁的吸氧腐蚀实验。一段时间后,溶液略显浅绿色,表明铁被 (填“氧化”或“还原”);向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。
(2)装置2中的石墨是 极(填“正”或“负”),该装置发生的总反应的离子方程为 。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为 极;甲烧杯中铁电极的电极反应为 。
②乙烧杯中电解反应的离子方程式为 。
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64 g,甲烧杯中产生的气体标准状况下体积为 mL。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省宁波市十校高三3月联考理综化学试卷(解析版) 题型:填空题
2013年10月我市因台风菲特遭受到重大损失,市疾控中心紧急采购消毒药品,以满足灾后需要。复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H2O2是一种无色粘稠液体,请回答下列问题:
(1)下列方程中H2O2所体现的性质与其可以作为消毒剂完全一致的是??????? 。
A.BaO2+2HCl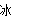 H2O2+BaCl2
H2O2+BaCl2
B.Ag2O+H2O2 =2Ag+O2+H2O???
C.2H2O2 2H2O+O2↑
2H2O+O2↑
D.H2O2+NaCrO2+NaOH=Na2CrO4 +H2O
(2)火箭发射常以液态肼(N2H4)为燃料,液态H2O2为助燃剂。已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g)? △H= - 534 kJ·mol-1???
H2O2(1)=H2O(1)+1/2O2(g)? △H= - 98.64 kJ·mol-1
H2O(1)=H2O(g)? △H=+44kJ·mol-l
则反应N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)的△H=?????????? ,
该反应的△S=??????? 0(填“>”或“<”)。
(3)H2O2是一种不稳定易分解的物质。
①如图是H2O2在没有催化剂时反应进程与能量变化图,请在图上画出使用催化剂加快分解速率时能量与进程图

②实验证实,往Na2CO3溶液中加入H2O2也会有气泡产生。已知常温时H2CO3的电离常数分别为Kal=4.3×l0-7,Ka2 = 5.0 ×l0-11 。Na2CO3溶液中CO32-第一步水解常数表达式Khl=????? ,常温时Khl的值为??????????? 。若在Na2CO3溶液中同时加入少量Na2CO3固体与适当升高溶液温度,则Khl的值
?????????? (填变大、变小、不变或不确定)。
(4)某文献报导了不同金属离子及其浓度对双氧水氧化降解海藻酸钠溶液反应速率的影响,实验结果如图1、图2所示。

注:以上实验均在温度为20℃、w(H2O2)=0.25%、pH=7.12、海藻酸钠溶液浓度为8mg·L-l的条件下进行。图1中曲线a:H2O2;b:H2O2+Cu2+;c:H2O2+Fe2+;d:H2O2+Zn2+;e:H2O2+Mn2+;图2中曲线f:反应时间为1h;g:反应时间为2h;两图中的纵坐标代表海藻酸钠溶液的粘度(海藻酸钠浓度与溶液粘度正相关)。
由上述信息可知,下列叙述错误的是????????????????? (填序号)。
A.锰离子能使该降解反应速率减缓
B.亚铁离子对该降解反应的催化效率比铜离子低??????
C.海藻酸钠溶液粘度的变化快慢可反映出其降解反应速率的快慢?????
D.一定条件下,铜离子浓度一定时,反应时间越长,海藻酸钠溶液浓度越小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com