
ij��Һ�������������еļ��֣��������������ӵ����ʵ���Ũ�Ⱦ�Ϊ0��lmol/L������ˮ�ĵ��뼰���ӵ�ˮ�⣩��K+ Ag+ Mg2+ Al3+ NH4+ Cl�� CO32�� NO3�� SO42�� I��
�����¸���ʵ���������Һ��ɣ�
��ȡ5mL��Һ��������ϡ��ˮ��������Һ���г������ɣ��������������ӣ�
���ò�˿պȡ��Һ���ڻ��������գ�����ɫ�겣���۲죬���治����ɫ��
����ȡ��Һ����������ᣬ����ɫ�������ɣ�����ɫ������������ɺ���ɫ��
�������ʵ�����õ���Һ�м���BaCl2��Һ���а�ɫ�������ɣ�
��ش��������⣺
��1���ɲ�����жϣ���Һ��һ�������е��������������������������ɫ����Ļ�ѧʽ������
����ȷ����Һ��������������������
��3����ȡ100mLԭ��Һ������������NaOH��Һ����ַ�Ӧ����ˣ�ϴ�ӣ����ճ��������أ��õ��Ĺ��廯ѧʽΪ������
���㣺 �������ӵļ��鷽����
ר�⣺ ���ӷ�Ӧר�⣮
������ ��ȡ����ɫ��Һ5mL��˵��һ��������ɫ��Cu2+���μ�һ�ΰ�ˮ�г������ɣ��������������ӣ�˵�����ӵ���NH4+������ԭ��Һ��һ������NH4+�����ܺ���Mg2+��Al3+������NH4+��CO32����
���ò�˿պȡ��Һ���ڻ��������գ�����ɫ�겣���۲죬����ɫ���棬˵����Һ�в���K+��
����ȡ��Һ�����������ᣬ����ɫ�������ɣ�����ɫ������������ɺ���ɫ��˵���л�ԭ������I����NO3����H+��Ӧ����NO������Һ����I����NO3�����ж�һ��������Ag+��
����������õ���Һ�м���BaCl2��Һ���а�ɫ�������ɣ�˵����SO42����
�������Ϸ������н��
��� �⣺���ݢ�ȡ����ɫ��Һ5mL��֪һ��������Cu2+���μ�һ�ΰ�ˮ�г������ɣ��������������ӣ�˵�����ӵ���NH4+������ԭ��Һ��һ������NH4+�����ܺ���Mg2+��Al3+������NH4+��CO32�������ò�˿պȡ��Һ���ڻ��������գ�����ɫ�겣���۲죬����ɫ���棬˵��û��K+�� ����ȡ��Һ�����������ᣬ����ɫ�������ɣ�����ɫ������������ɺ���ɫ��˵���л�ԭ������I����NO3����H+��Ӧ����NO������Һ����I����NO3�����ж�һ��������Ag+������������õ���Һ�м���BaCl2��Һ���а�ɫ�������ɣ�˵����SO42����
��1���ò�˿պȡ��Һ���ڻ��������գ�����ɫ�겣���۲죬����ɫ���棬˵��û��K+�����м�����������������ɫ���壬��I����NO3����H+��Ӧ����NO�������ӷ���ʽΪ��6I��+2NO3��+8H+�T3I2+2NO��+4H2O��
�ʴ�Ϊ��K+��NO��
������������֪һ�����е�������I����NO3����SO42�����Ҹ�Ϊ0.1mol/L�����ݵ���غ��֪���ƶϳ��������Ӻ���Mg2+��Al3+����Ũ��Ϊ0.1mol/L���ɵ���غ��֪��Һ�л���һ�֩�1�۵�������ΪCl�������Լ�ͬѧ����ȷ��ԭ��Һ�������������ǣ�Mg2+��Al3+���������ǣ�Cl����I����NO3����SO42����
�ʴ�Ϊ��Cl����I����NO3����SO42����
��3����ȡ100mLԭ��Һ������������NaOH��Һ��Mg2+��Al3+ ��Ӧ����Mg��OH��2��NaAlO2���漰�����ӷ���ʽΪMg2++2OH���TMg��OH��2����Al3++4OH���TAlO2��+2H2O����ַ�Ӧ����ˣ�ϴ�ӣ����ճ��������أ�����Ϊ������þ�����յõ��Ĺ���ΪMgO��
�ʴ�Ϊ��MgO��
������ ���⿼���˳������ӵļ��飬��Ŀ�Ѷ��еȣ���ȷ�������ӵ����ʼ����鷽��Ϊ���ؼ���ע������ijЩ�������Ӿ��е����ʣ�����ɫ�����ԡ���ɫ��Ӧ�Ļ�����ɫ�ȣ�����Ϊ�������ͻ�ƿڣ�
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ���ǣ�������
| �� | A�� | CH3﹣CH=CH2����������ԭ��һ������ͬһƽ�� |
| �� | B�� | ��ȥ�����е���ϩ�ǽ�����ͨ������KMnO4��Һ�� |
| �� | C�� | ������̼����Ԫ�ص�����������ͬ�����ǿ�����ͬϵ�� |
| �� | D�� | ij����������Ϊ3��4��4һ�������� |
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й�ʵ�����������ȷ���ǣ�����ţ�������
A����NaOH��Һ��ȥ���������л��е����ᡢ�Ҵ���Ȼ���Һ
B������ʯ��ʱ���¶ȼƵ�ĩ�˱������Һ����
C���÷�Һ©�����뻷�����ˮ�Ļ��Һ��
D����Ũ��ˮϴ������������Ӧ���Թ�
E������������Һʱ����ϡ��ˮ�����μӵ�ϡ��������Һ�У�������ɫ����������μӵ������պ��ܽ�Ϊֹ
F������ˮ���ֱ�ӵμ�����������ͭ����Һ�����ȼ���ˮ������е������ǣ�
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ˮ��Һ��ֻ������K+��Mg2+��AlO2����SiO32����CO32����SO42���е����������ӣ�ijͬѧ����Һ��������ͼʵ�飺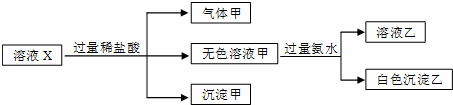
�����жϴ�����ǣ�������
�� A�� ����������ɣ�������ҺX��һ������CO32��
�� B�� �����ײ������ǹ���þ
�� C�� Al3+һ����������ҺX��
�� D�� ������ȷ��SO42���Ƿ��������ҺX��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£�pH=1��ij��ҺA�к���NH4+��K+��Na+��Fe3+��Al3+��Fe2+��CO32����NO3����Cl����I����SO42���е�4�֣��Ҹ����ӵ����ʵ���Ũ�Ⱦ�Ϊ0.1mol/L����ȡ����Һ�����й�ʵ�飬ʵ������ͼ��ʾ�������й�˵����ȷ���ǣ�������
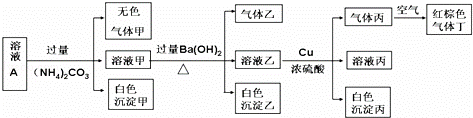
�� A�� ������һ����BaCO3��������BaSO4
�� B�� ʵ������Cu 14.4g�����������嶡�����Ϊ3.36L
�� C�� ����Һ��һ����NO3����Al3+��SO42����Cl����������
�� D�� ���ɵļס��ҡ��������Ϊ��ɫ��������ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������������������γ��������Ҫ���ʣ�ij�������п��ܺ����������ӣ�Na+��Ba2+��NH4+��Al3+��Cl����SO32����SO42����NO3���ȣ�ij�о�С��ȡ�õ�һ���������꣬Ũ�������ó�����Һ�ֳ�3�ݣ���������ʵ����
���� �����Լ� ʵ������
��һ����Һ �μ������ĵ���KI��Һ ����ɫ
�ڶ�����Һ �μ��������λ���BaCl2��Һ �а�ɫ����
��������Һ �μ���Һ�����ȣ����������������Һ�����V�������ɵij����������������ϵ��n������ͼ�� 
��ش��������⣺
��1������ʵ�����жϸ������п϶������ڵ�������������
д����Һ�еμӵ���KI��Һ��������Ӧ�����ӷ���ʽ������
��3�����ʵ�鷽�����������Һ���Ƿ����Cl��������
��4�����о�С��Ϊ��̽��NO�����������������γɣ�����ƿ�г��뺬������NO��SO2���壬������ͨ��O2��������ѧ��Ӧ����������������ˮ�������������꣬��NO��������Ӧ�е�������������
��5����0.5L�ܱ������ڼ���NO2��SO2��Ϊ�˲ⶨ��ij�ִ��������·�Ӧ��NO2��g��+SO2��g��⇌NO��g��+SO3��g���ķ�Ӧ���ʣ���t0C�����崫������ò�ͬʱ���NO2��SO2Ũ����������������¶ȱ仯�Դ�����Ч�ʵ�Ӱ�죩��
ʱ��/s 0 1 2 3 4 5
c��NO2��/mol•L��1 1.00��10��3 4.50��10��4 2.50��10��4 1.50��10��4 1.00��10��4 1.00��10��4
c��SO2��/mol•L��1 3.60��10��3 3.05��10��3 2.85��10��3 2.75��10��3 2.70��10��3 2.70��10��3
��ǰ2s��NO��ƽ����Ӧ����v��NO��=����
��t��÷�Ӧ�Ļ�ѧƽ�ⳣ��K=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������ʵ����X+Y2+=X2++Y����Z+H2O���䣩=Z��OH��2+H2������Z2+�����Ա�X2+��������Y��W�缫��ɵĵ�أ��缫��ӦΪW2++2e﹣=W��Y﹣2e﹣=Y2+����֪X��Y��Z��W�Ļ�ԭ����ǿ������˳��Ϊ����
A�� X��Z��Y��W B�� Z��W��X��Y C�� Z��Y��X��W D�� Z��X��Y��W
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������ȷ����(����)
A�ױ��ȿ�ʹ������Ȼ�̼��Һ��ɫ��Ҳ��ʹ���Ը��������Һ��ɫ
B���л���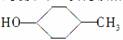 ����ȥ����������
����ȥ����������
C���л���A(C4H6O2)�ܷ����Ӿ۷�Ӧ������֪A�Ľṹһ����
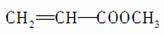
D��������ˮ����ױ������ӡ�1��ϩ������ɫҺ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵���в���ȷ����( )
A�������Ħ��������6.02��1023��������ӵ���������ֵ�����
B��6.02��1023�������Ӻ�6.02��1023������ӵ������ȵ���14��1
C��32g����������ԭ����ĿΪ2��6.02��1023
D�����³�ѹ�£�0.5��6.02��1023��һ����̼������ռ�����11.2L
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com