
分析 (1)含有6个质子、8个中子的原子为C,其质量数为14;
(2)周期表中8、9、10三个纵行为ⅤⅢ族;
(3)周期表中最活泼金属元素为第ⅠA族;
(4)决定原子种类的微粒是质子和中子;
(5)1~18号元素的化合价主要由最外层电子数,以此来解答.
解答 解:(1)含有6个质子、8个中子的原子为C,其质量数为14,原子的化学符号为614C,故答案为:614C;
(2)周期表中8、9、10三个纵行为ⅤⅢ族,则周期表中位于第8纵行的铁元素属于第ⅤⅢ族,故答案为:ⅤⅢ;
(3)周期表中最活泼金属元素为第ⅠA族,则最活泼金属元素位于第1纵行,故答案为:1;
(4)决定原子种类的微粒是质子和中子,故答案为:质子和中子;
(5)1~18号元素的化合价主要由最外层电子数,故答案为:最外层电子数.
点评 本题考查元素周期表的结构及应用,为高频考点,把握周期表结构及元素的位置、元素的种类为解答的关键,侧重基础知识的考查,题目难度不大.


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 卤素单质 Cl2、Br2、I2的氧化性强弱 | |
| B. | 气态氢化物 NH3、H2O、HF 的稳定性 | |
| C. | 碱金属单质 Li、Na、K 与水反应的剧烈程度 | |
| D. | 1mol Na、Mg、Al 分别与足量盐酸反应时失电子数的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
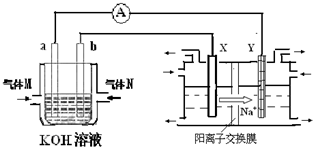
| 时间(h) 物质的量/(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氯是纯净物,氯水是电解质,漂白粉是混合物 | |
| B. | 氯气可用作消毒剂和漂白剂,是因为氯分子具有强氧化性 | |
| C. | 随着化合价的升高,氯的含氧酸酸性和氧化性均逐渐增强 | |
| D. | 不能用pH试纸测定氯水的pH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com