
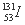 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中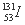 的含量变化检测核电站是否发生放射性物质泄漏。下列有关
的含量变化检测核电站是否发生放射性物质泄漏。下列有关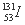 的叙述中错误的是( )
的叙述中错误的是( )
A. 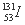 的化学性质与
的化学性质与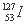 相同 B.
相同 B. 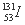 的原子序数为53
的原子序数为53
C. 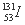 的原子核外电子数为78 D.
的原子核外电子数为78 D. 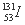 的原子核内中子数多于质子数
的原子核内中子数多于质子数
科目:高中化学 来源: 题型:
两种微粒含有相同的质子数和电子数,这两种微粒可能是
①两种不同的原子;②两种不同元素的原子;③一种原子和一种分子;④一种原子和一种离子;⑤两种不同分子;⑥一种分子和一种离子;⑦两种不同阳离子;⑧两种不同阴离子;⑨一种阴离子和一种阳离子
A.①③⑤⑥⑦⑧ B.①③⑤⑦⑧
C.①③④⑤⑦ D.全部都是
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为长式周期表的一部分,其中的序号代表对应的元素。
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ||||||||||||||||
|
| ⑨ | ⑩ |
(1)写出上表中元素⑨原子的外围电子排布式__________。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为__________杂化;元素⑦与⑧形成的化合物的晶体类型是__________。
(3)元素④的第一电离能__________元素⑤(填写“>”“=”或“<”)的第一电离能;元素④与元素①形成的最简单的X分子的空间构型为__________。请写出与元素④的单质互为等电子体分子、离子的化学式__________(各写一种)。
(4)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是__________。
 (5)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为__________。
(5)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为__________。
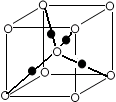
(6)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,反应的离子方程式为__________;元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则一个晶胞中所包含的氧原子数目为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
矿石中金的含量很低,金的性质又相当稳定,只能用湿法冶金——氰化法提炼,即采用稀的NaCN溶液处理已粉碎的矿石,把少量的金浸入溶液中,然后用金属锌作还原剂将金从溶液中置换析出。其反应原理为
①4Au+8NaCN+O2+2H2O 4Na[Au(CN)2]+4NaOH;
4Na[Au(CN)2]+4NaOH;
②2Na[Au(CN)2]+Zn 2Au+Na2[Zn(CN)4]。
2Au+Na2[Zn(CN)4]。
以下有关氰化法提炼金的说法中正确的是( )
A.Na[Au(CN)2]不溶于水
B.化合物Na[Au(CN) 2]中金元素的化合价为+1
C.金元素在地壳中能以化合态的形式存在
D.在提炼过程中含金元素的物质始终作氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
铋(Bi)是第VA族元素,+5价Bi的化合物氧化性大于MnO4—。某反应中反应物与生成物有:NaMnO4、NaBiO3、Na2SO4、MnSO4、Bi2(SO4)3、H2O和一种未知物X。下列关于该反应的描述中不正确的是( )
A.X是H2SO4
B.反应中Mn原子与Bi原子个数比为5:2
C.该反应中NaBiO3作氧化剂
D.该反应中Na2SO4既不是氧化产物,又不是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
请回答:(1)形成化合物种类最多的元素是 (填元素符号)。
(2)在①、②、③三种元素的氧化物对应的水化物中,碱性最强的是 (填化学式)。
(3)①、②、③三种元素按离子半径由大到小的顺序依次为 (填离子符号)。
(4)⑥元素形成的具有强氧化性的氢化物电子式是 , 该元素另一种氢化物在常温下与②发生反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是 ( )
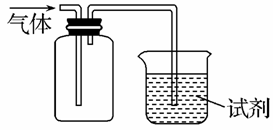
| 选项 | 试剂 | 现象 | 结 论 |
| A | 酸性KMnO4溶液 | 溶液褪色 | SO2有氧化性 |
| B | 品红溶液 | 溶液褪色 | SO2有漂白性 |
| C | NaOH溶液 | 无明显现象 | SO2与NaOH 溶液不反应 |
| D | 紫色石蕊试液 | 溶液变红色 后不褪色 | SO2有酸性,没 有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
请按要求写出下列化学方程式
①乙烯使硫酸酸化的高锰酸钾溶液褪色(乙烯被氧化为二氧化碳,高锰酸钾被还原为硫酸锰MnSO4)。
②甲苯在浓硫酸作催化剂的条件下与浓硝酸反应生成三硝基甲苯。
③乙醇使硫酸酸化的重铬酸钾溶液变色(乙醇被氧化为乙酸,重铬酸钾被还原为硫酸铬)。
④乙烯与氧气在银作催化剂的条件下反应生成环氧乙烷,且该反应的原子利用率为?
⑤对苯甲二甲酸与乙二醇缩聚反应生成聚酯纤维(涤纶)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,测得0.1 mol·L-1CH3COOH溶液的PH为3.0。则CH3COOH在水中的电离度为 ,此温度CH3COOH的电离平衡常数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com