
(6分)开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4-构成,BH4 -呈正四面体构型。LiBH4中不存在的作用力有______(填标号)。
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为______。
(2) 金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
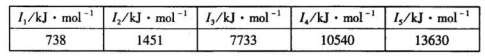
M是______(填元素符号)。
(3)某种新型储氧材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有______种。
(1)1 C H>B>Li (2) < Mg (3) 3 (4) B、C
【解析】
试题分析:(1)①钛是22号元素,基态Ti3+的电子排布式为1s22s22p63s23p64s1,未成对电子数为1;②Li+和BH4—之间存在离子键,BH4—之间存在共价键和配位键,则LiBH4中不存在金属键,选C;③LiBH4中Li和H同主族,Li和B同周期,由元素周期律可知,则锂元素的电负性最小,BH4—中硼显+3价,氢显—1价,说明氢的电负性比硼大,则电负性由大到小排列顺序为H>B>Li;(2)①Li+和H—具有具有相同的电子层结构,核电荷数:Li>H,则离子半径:Li+<H—;②根据M的部分电离能数据推断,M容易失去2个电子,为镁元素;(3)(4)试题不全,无法解析。
考点:考查基态原子或离子的电子排布式、化学键的类型、电负性和离子半径的大小、电离能等。


科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
关于NaOH溶液和Fe(OH)3胶体描述正确的是
A.两者的分散质都属于碱
B.两者均为有色不透明的分散系
C.两者分散质的直径都介于10-9~10- 7m之间
D.一束光线分别通过时,两者都会产生“丁达尔效应”
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列关于Na2O2的叙述正确的是
A.Na2O2晶体中的阴离子与阳离子的物质的量之比为1∶1
B.Na2O2晶体为离子晶体,且含极性共价键
C.Na2O2应保存于带玻璃塞的广口瓶中
D.Na2O2与盐酸反应,不仅有盐和水生成,同时会放出无色气体
查看答案和解析>>
科目:高中化学 来源:2015届福建省福州市高三上学期第三次质检理综化学试卷(解析版) 题型:填空题
(13分)【化学一有机化学基础】
I.莽草酸是有效应对H5N1型禽流感病毒的药物“达菲”的重要成分。

(1)莽草酸中可发生加成反应的官能团为______ (填名称)。
(2)等物质的量的莽草酸、甲、乙分别与NaOH溶液完全反应,消耗NaOH的物质的量之比为______。
(3)写出符合以下条件的莽草酸的同分异构体的结构简式____________。
(i)链状结构,含三种氢,有两个甲基。
(ii)能与NaOH溶液反应。
II.PET为聚合物,用于生产矿泉水塑料瓶。PET生产流程如下图:

已知:A、B、C、D、E都是苯的对位二元取代物,A为烃,E与邻苯二甲酸互为同分异构体。
(4)B→C的反应类型为______。
(5)能鉴别C和D的试剂是______。
(6)E与乙二醇反应生成PET的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源:2015届福建省福州市高三上学期第三次质检理综化学试卷(解析版) 题型:选择题
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是

A.a为电池的正极
B.电池充电反应为LiMn2O4 Li1-xMn2O4+xLi
Li1-xMn2O4+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
同温同压下,相同体积的CO和CO2,下列比较中正确的是( )
①所含的分子数目之比为1︰1 ②所含的O原子数目之比为1︰2
③所含的原子总数目之比为2︰3 ④两者的密度之比为:7:11
⑤所含的电子数目之比为7︰11
A.①和④ B.②和③ C.④和⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
下列各组试剂中,只用试管和胶头滴管,不用其他试剂就可以鉴别的是( )
A.NaHSO4溶液和Na2CO3溶液 B.稀盐酸和AgNO3溶液
C.AlCl3溶液和NH3·H2O溶液 D.Ba(OH)2溶液和NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源:2015届福建省、安溪一中高三上学期期中联考化学试卷(解析版) 题型:实验题
(14分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
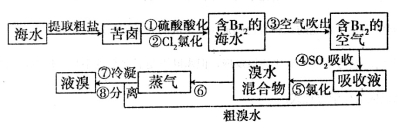
(1)步骤①中用硫酸酸化的目的是____________________________________________。
步骤②发生反应的离子方程式为_____________________________________________。
(2)步骤④利用了SO2的还原性,反应的离子方程式为___________________________。
(3)操作⑥的名称是________________。
(4)从含溴海水中吹出的溴也可用纯碱吸收。纯碱吸收溴的主要反应是:Na2CO3+Br2→NaBrO3+NaBr+CO2,吸收1molBr2时,转移的电子数为________mol。纯碱吸收后再用硫酸酸化,单质溴又从溶液中析出。
(5)化学上将SCN 、OCN
、OCN 、CN
、CN 等离子称为“类卤离子”。现将KSCN溶液滴加到酸性Fe3+溶液中,溶液立即变成血红色;通入SO2后,血红色消失。血红色消失过程中发生反应的离子方程式为______________________________________。
等离子称为“类卤离子”。现将KSCN溶液滴加到酸性Fe3+溶液中,溶液立即变成血红色;通入SO2后,血红色消失。血红色消失过程中发生反应的离子方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届福建省、安溪第一中学高三9月摸底考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在溶液中一定能大量共存的是
A.pH=12的溶液:K+、Na+、CH3COO—、CO32—
B.与铝反应产生大量氢气的溶液:Mg2+、K+、HCO3—、NO3—
C.由水电离产生的c(H+)=10-13mol/L的溶液:NH4+、Ca2+、SO32—、Cl—
D.0.1 mol/L的NaNO3溶液:H+、Fe2+、Cl—、SO42—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com