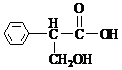在下列物质中:①NaOH、②H2O2、③NH4Cl、④Na2O2、⑤C2H2、⑥SiC晶体 ⑦Na2S⑧单晶硅。用序号回答下列问题:
⑴含有极性共价键的原子晶体是________;
⑵只含有离子键的离子晶体是________;
⑶既含有离子键又含有非极性共价键的离子晶体是________;
⑷ 既含有离子键,又含有极性共价键和配位键的离子晶体是________;
⑸含有极性共价键和非极性共价键的非极性分子是________;
⑹含有极性共价键和非极性共价键的极性分子是________。
⑥ , ⑦ , ④, ③ , ⑤, ②
试题分析:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。离子间通过离子键形成的晶体是离子晶体,分子间通过分子间作用力形成的晶体是分子晶体,原子间通过共价键形成的空间网状结构的晶体是原子晶体,由金属阳离子和自由电子构成的晶体是金属晶体,据此可知:
⑴含有极性共价键的原子晶体是碳化硅,答案选⑥;
⑵只含有离子键的离子晶体是硫化钠,答案选⑦;
⑶既含有离子键又含有非极性共价键的离子晶体是过氧化钠,答案选④;
⑷ 既含有离子键,又含有极性共价键和配位键的离子晶体是氯化铵,答案选③;
⑸含有极性共价键和非极性共价键的非极性分子是乙炔,答案选⑤;
⑹含有极性共价键和非极性共价键的极性分子是双氧水,答案选②。
考点:考查晶体类型、化学键以及分子极性的判断
点评:该题是常识性知识的考查,试题基础性强,紧扣教材基础知识,旨在提高学生的应试能力和学习效率。该题的关键是明确晶体类型、化学键以及分子极性的判断,并能结合题意灵活运用即可。