
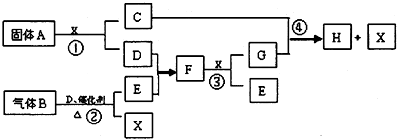
 ;
; ;
;

科目:高中化学 来源: 题型:




查看答案和解析>>
科目:高中化学 来源: 题型:
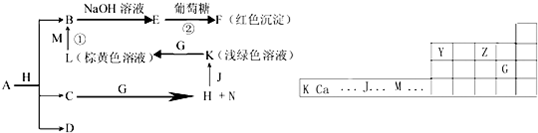
查看答案和解析>>
科目:高中化学 来源: 题型:
(分)三种短周期元素X、Y、Z两两之间可形成原子个数比均为1:1的三种化合物A、B、C。已知A、B均为离子晶体,构成A晶体的阴离子X-和构成B晶体的阳离子Z+分别与He和Ne具有相同的核外电子排布,常温下,A、B与水都能发生剧烈反应,分别生成无色气体R和W;由X、Y两元素组成的化合物C的水溶液中加入少量MnO2,也发生剧烈反应,放出气体W。据此回答:
(1)Y是 (填元素名称)
(2)向C的水溶液中滴入紫色石蕊试液充分振荡后石蕊试液褪色,说明C具有 性。
(3)化合物B的电子式为
(4)写出A与水反应的化学方程式
查看答案和解析>>
科目:高中化学 来源:2014届广东省佛山市高二下学期期中考试化学试卷(解析版) 题型:实验题
一氯甲烷,也叫甲基氯,常温下是无色气体,密度为0.9159克/厘米3,熔点为-97.73℃,沸点为-24.2℃,18℃时在水中的溶解度为280毫升/毫升水,与乙醚、丙酮或苯互溶,能溶于乙醇。在实验室里可用下图装置制取一氯甲烷:

制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸。
试填写下列空白:
(1)制备一氯甲烷的化学方程式 ,
(2)装置b的作用是 ;
(3)已知卤代烃能发生碱性水解,转化为醇。装置e中可能发生的反应方程式为
;
(4)检验气体产物CH3Cl的方法是:在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其它烃燃烧现象有明显区别)。CH3Cl燃烧的化学方程式是 ;
(5)实验中实际按甲醇和浓盐酸1︰2(物质量之比)进行反应的理由是 ;
(6)某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇~浓盐酸的混和液的量比正常情况下多(装置的气密性没有问题),其原因是 ;
(7)实验结束后,d中收集到的液体中含有 。
查看答案和解析>>
科目:高中化学 来源:2011年浙江省杭州市萧山区高考化学模拟试卷(四)(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com