
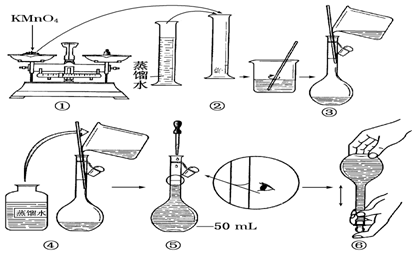
分析 (1)根据配制一定物质的量浓度的溶液的正确操作结合图示分析解答;
(2)容量瓶是确定溶液体积的仪器;
(3)依据仰视刻度线,会使溶液体积偏大判断,结合C=$\frac{n}{V}$分析;
(4)草酸跟酸性KMnO4溶液反应生成二氧化碳、二价锰离子等,结合氧化还原反应得失电子守恒和根据电荷守恒进行分析写出化学方程式得到x;
(5)滴定时,用高锰酸钾滴定草酸,反应达到终点时,滴入的高锰酸钾溶液不褪色,据此判断;
(6)根据滴定数据及钙离子与高锰酸钾的关系式计算出血液样品中Ca2+的浓度.
解答 解:(1)由图示可知②⑤操作不正确,②不能在量筒中溶解固体,⑤定容时应平视刻度线,至溶液凹液面与刻度线相切,故答案为:②⑤;
(2)应该用容量瓶准确确定50mL溶液的体积,故答案为:容量瓶;
(3)如果用图示的操作配制溶液,由于仰视刻度线,会使溶液体积偏大,所配制的溶液浓度将偏小,故答案为:偏小;
(4)根据电荷守恒,(-1×2)+(+1×6)=+x×2,解得,x=2,草酸跟KMnO4反应的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,
故答案为:2;
(5)滴定时,用高锰酸钾滴定草酸,反应达到终点时的现象为溶液由无色变为紫红色,且半分钟内不褪色,
故答案为:溶液由无色变为紫红色,且半分钟内不褪色;
(6)血样20.00mL经过上述处理后得到草酸,草酸消耗的消耗的高锰酸钾的物质的量为:0.020mol/L×0.012L=2.4×10-4mol,
根据反应方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,及草酸钙的化学式CaC2O4,可知:n(Ca2+)=n(H2C2O4)=$\frac{5}{2}$n(MnO4-)=2.5×2.4×10-4mol=6
10-4mol,Ca2+的质量为:40g/mol×6×10-4mol=0.024g,钙离子的浓度为:$\frac{0.024g}{20cm{\;}^{3}}$=1.2 mg/cm3,
故答案为:1.2.
点评 本题考查了配制一定物质的量浓度的方法及误差分析,题目难度不大,注意掌握配制一定浓度的溶液的方法及误差分析方法及技巧


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| 序号 | 物质 | 试剂 | 分离方法 |
| ① | 硝酸钾(氯化钠) | 蒸馏水 | 重结晶 |
| ② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| ③ | 乙醇(水) | 金属钠 | 蒸馏 |
| ④ | NaCl溶液(Na2S) | AgCl | 过滤 |
| A. | ①③ | B. | ①④ | C. | ② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中3个碳原子在同一直线 | B. | 分子中所有原子在同一平面上 | ||
| C. | 与氯化氢加成只生成一种产物 | D. | 能发生加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶 液 | 加入的物质 | 答案序号 |
| (1)饱和石灰水 | CO2 | |
| (2)AlCl3溶液 | 过量NH3 | |
| (3)含少量NaOH的NaAlO2 | 过量CO2 | |
| (4)含少量NaOH的NaAlO2 | 逐滴加稀盐酸 | |
| (5)MgCl2、AlCl3混合液 | 逐滴加NaOH至过量 | |
| (6)NaOH溶液 | 逐滴加AlCl3至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、CH4的分子数之比为1:1 | B. | NH3、CH4两种气体的密度之比为a:b | ||
| C. | NH3、CH4的摩尔质量之比为17:16 | D. | NH3、CH4的物质的量之比为a:b |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL,分别进行了如下实验:
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL,分别进行了如下实验:| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 | pH=3,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
| 操作 | 现象 |
| 取5mLpH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com