
【题目】锌在电池制造方面有着重要的作用,也是人体必需的微量元素之一。它与常见的非金属都可以形成重要的化合物。
(1)Zn的核外电子排布式是[Ar]___。
(2)Zn的各级电离能数据如下表所示:

①请依据表中数据说明锌的常见化合价为+2的原因是___。
②氧、硫、氯三种常见非金属的电负性,由大到小的顺序是___。二氯化硫为鲜红色液体,熔点-78℃,则其晶体中微粒间的作用力应属于___,它的分子中中心原子具有的孤电子对数是___。
(3)氯化锌易溶于水,在水中形成配合物H[ZnCl2(OH)],H[ZnCl2(OH)]在水中电离时的离子方程式为___。
(4)晶胞的空隙问题是晶胞研究的重要内容。
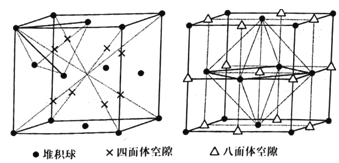
①已知面心立方晶胞的四面体空隙和八面体空隙状况如图所示。面心立方晶胞的每个晶胞中,堆积球数:四面体空隙数:八面体空隙数=___。
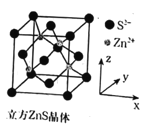
②根据立方ZnS晶胞示意图,描述在每个晶胞中,锌离子填充在硫离子的立方面心晶胞空隙中的方式为___。离坐标参数为(0,0,0)的硫离子最近的锌离子坐标参数为___ (参数数值限定为正值)。
【答案】3d104s2 因为第2和第3级电离能的差值远高于第2和第1级的差值 O>Cl>S 范德华力 2 H[ZnCl2(OH)]=[ZnCl2(OH)]-+H+ 1:2:1 锌离子填充到硫离子面心晶胞的一半四面体空隙中(或锌离子填充到硫离子面心晶胞的8个四面体空隙的4个中) (![]() ,
,![]() ,
,![]() )
)
【解析】
Zn是30号元素,价电子为3d104s2,失去第三个电子非常困难,第三电离能较大;电负性的大小比较根据元素周期律的知识;由熔沸点确定晶体类型,得到晶体中微粒间的作用力;孤电子对数的计算用最外层电子数减去成键电子数,再除以2;四面体空隙:由四个球体围成的空隙,球体中心线围成四面体;八面体空隙:由六个球围成的空隙,球体中心线围成八面体形;坐标参数的确定先找出位置,再确定到到x、y、z轴的距离,得到坐标参数。
(1) Zn是30号元素,核外电子排布式是[Ar] 3d104s2;
(2)①Zn的价电子为3d104s2,失去最外的两个电子就形成稳定结构,再失去电子就比较困难,电离能会增加很多,原因是因为第2和第3级电离能的差值远高于第2和第1级的差值;
②同一周期中,元素的电负性随着原子序数的增大而增大,有Cl>S,同一主族,元素的电负性随着原子序数的增大而减小,有O>S,氧原子的半径小于氯,吸引电子能力强,有O>Cl,所以电负性O>Cl>S;二氯化硫为液体,熔点-78℃,熔沸点都较低,为分子晶体,则其晶体中微粒间的作用力应属于范德华力;二氯化硫分子中,氯原子最外层7个电子,形成一对公用电子对,硫原子最外层6个电子,中心原子硫原子具有的孤电子对数是![]() ;
;
(3) 配合物中外界电离成离子,內界不电离,所以H[ZnCl2(OH)]在水中电离时的离子方程式为[ZnCl2(OH)]=[ZnCl2(OH)]-+H+;
(4) ①堆积球数采用均摊法,![]() ;根据图四面体空隙位于八分之一晶胞的立方体心位置,一共有8个;八面体空隙位于晶胞体心(1个)和棱心(
;根据图四面体空隙位于八分之一晶胞的立方体心位置,一共有8个;八面体空隙位于晶胞体心(1个)和棱心(![]() 个),一共有4个;所以堆积球数:四面体空隙数:八面体空隙数=1:2:1;
个),一共有4个;所以堆积球数:四面体空隙数:八面体空隙数=1:2:1;
②根据立方ZnS晶胞示意图,每个硫离子的面心晶胞有8个四面体空隙,锌离子只填充了4个,所以答案为:锌离子填充到硫离子面心晶胞的一半四面体空隙中(或锌离子填充到硫离子面心晶胞的8个四面体空隙的4个中);如下图,将a球设为坐标原点,离硫离子最近的锌离子为b球,b球在周围4个硫离子(a球和a球对应的三个面的面心)的中心,则b球到x、y、z轴的距离都是![]() ,坐标参数为(
,坐标参数为(![]() ,
,![]() ,
,![]() )。
)。



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列反应既属于离子反应,又属于氧化还原反应的是( )
A. NaOH溶液与盐酸中和B. Zn与CuSO4 溶液的反应
C. 分解氯酸钾制氧气D. MgCl2溶液 与KOH溶液产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是![]() 和
和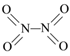 。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式_________________________
(2)对反应N2O4(g)![]() 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是______
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是______
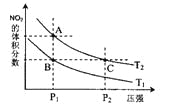
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为_____mol·(L·s)-1。
②n3____n4(填“>”、“<”或“=”),该反应的平衡常数K的值为_____________,升高温度后,反应2NO2![]() N2O4的平衡常数K将_______(填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将_______(填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2
④计算③中条件下达到平衡后混合气体的平均相对分子质量为____________。(结果保留小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研制出丁苯酞,标志着我国在脑血管疾病治疗药物研究领域达到了国际先进水平。合成丁苯酞(J)的一种路线如下:
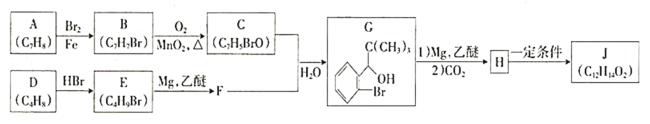
已知:
①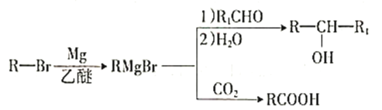
②E的核磁共振氢谱只有一组峰;
③J是一种酯,分子中除苯环外还含有一个五元环。
回答下列问题:
(1)A的化学名称为________,H中官能团的名称为________、________。
(2)由A生成B反应类型为__________________。
(3)由D生成E的化学方程式为__________________。
(4)J的结构简式为________________。
(5)![]() 与CO2反应生成X,X的同分异构体中:
与CO2反应生成X,X的同分异构体中:
①能发生水解反应;②能发生银镜反应;能与氯化铁溶液发生显色反应。
满足上述条件X的同分异构体共有________种(不考虑立体异构),写出核磁共振氢谱有五组峰的同分异构体结构简式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘酸钾常用作食盐加碘剂以防止缺碘疾病,也是常用的基准物质和氧化剂。工业上碘酸钾可用如图所示装置进行制备。下列说法错误的是( )
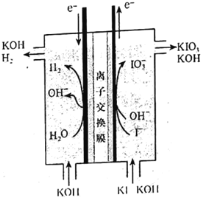
A.其阳极反应式是I-+3H2O-6e-=IO![]() +6H+
+6H+
B.该工业过程中KOH是循环利用的物质
C.制得21.4gKIO3产生标况下H26.72L
D.该工业过程使用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
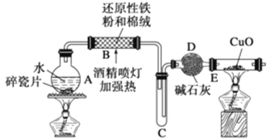
探究一:设计如图所示装置进行“铁与水反应”的实验
(1)硬质玻璃管E中反应的化学方程式为_________
(2)反应前A中投放碎瓷片的目的是_________
(3)装置E中的现象是_________
探究二:设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
实验操作:待硬质玻璃管B冷却后,取少许其中的固体物质溶于稀硫酸后,将所得溶液分成两份。
(4)一份滴加几滴KSCN溶液。若溶液变血红色,推断硬质玻璃管B中固体物质的成分为________(选填序号,下同);写出溶液变血红色的离子方程式:____________,若溶液未变血红色,推断硬质玻璃管B中固体物质的成分为_________。
①一定有Fe3O4 ②一定有Fe ③只有Fe3O4 ④只有Fe
(5)另一份用_________(填仪器名称),加入_________(填试剂),观察观察到_________(填实验现象),可以证明溶液中存在Fe2+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3A(g)![]() 3B(?)+C(?) △H>0达到化学平衡后,
3B(?)+C(?) △H>0达到化学平衡后,
(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
a.若B、C都是气体,气体的平均相对分子质量①___;
b.若B、C都不是气体,气体的平均相对分子质量②____;
c.若B是气体,C不是气体,气体的平均相对分子质量③___;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是④___态,C是⑤___态。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:
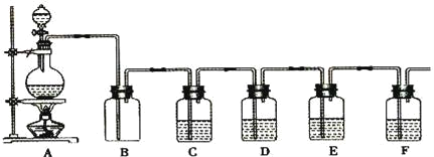
(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电镀锡渣(主要含![]() 、
、![]() )联合生产氯化亚锡和硫酸亚锡晶体,其工艺流程如下:
)联合生产氯化亚锡和硫酸亚锡晶体,其工艺流程如下:

已知:①![]() 易水解生成碱式氯化亚锡
易水解生成碱式氯化亚锡![]() ;②在水溶液中,
;②在水溶液中,![]() 易被氧化为
易被氧化为![]() 。
。
请回答下列问题:
(1)锡在周期表中的位置为___________。
(2)已知反应I得到的沉淀是![]() ,产生气体的结构式为_____,反应的化学方程式为_______。
,产生气体的结构式为_____,反应的化学方程式为_______。
(3)图中滤液的主要成分为_______________、_______________(写化学式)。
(4)酸溶时一般加入浓盐酸进行溶解,请用化学方程式及必要文字解释原因:______________。
(5)电镀锡渣中的锡与烧碱、硝酸钠溶液反应可生产锡酸钠,并产生一种碱性气体,该反应的化学方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com