
����Ŀ����ͼ��ʾװ�ÿ�������ȡ�۲�Fe(OH)2�ڿ����б���������ɫ�仯��ʵ��ʱ����ʹ����м��6mol/L�����ᣬ�����Լ���ѡ������������⣺
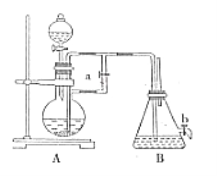
��1��B��ʢ��һ������NaOH��Һ��A��ӦԤ�ȼ�����Լ���_______________��A�з�����Ӧ��Ŀ����_____________________________��
��2��ʵ�鿪ʼʱӦ�Ƚ����ɼ�a________(�������������ر���)��
��3��װ��B������Fe(OH)2�IJ������۲쵽������Ϊ_______________��
��4��ʵ����ϣ���b�����ɼУ�����һ���ֿ�������ʱB�з����ķ�ӦΪ_________________________��
���𰸡���м �����������ų�װ���еĿ�������ֹ������������������ͬʱ����FeSO4�������ò�����������FeSO4ѹ��Bװ�ã� �� �رջ���a��������ѹǿ�������£�A�к���������������Һ��ѹ��B�в�����ɫ���� 4Fe(OH)2+O2+2H2O��4Fe(OH)3
��������
��1��A��ӦԤ��ʢ�Ź�̬��Ӧ�����ϡ���ᷢ��������ԭ��Ӧ�����������������������������ſ�����
��2������ʵ�鿪ʼʱ��Ҫʹ���ɵ�������������ʵ��װ���ж��ų���������ֹ�������������������ݴ��жϣ�
��3���رջ���ʱ��������ѹǿ�������£�A����Һ�ɽ���Bװ���У��ݴ˽��
��4���������������ȶ����ױ������������ɺ��ɫ��������������
��1��A��ӦԤ��ʢ�Ź�̬��Ӧ����м������ϡ���ᷴӦ�����������������������������ų�װ���еĿ�������ֹ������������������ͬʱ����FeSO4�������ò�����������FeSO4ѹ��Bװ�ã�
��2��ʵ�鿪ʼʱ��Ӧ�ȴ���a��ʹ���ɵ�������������ʵ��װ���ж��ų���������ֹ������������������
��3��A�з�Ӧ������Ϊ��֤������������B�к��������ƻ�ϣ�Ҫ��������������ѹǿ��������Ҫ�رջ���a��������ѹǿ�������£�A�к���������������Һ��ѹ��B�У���������������������Һ��Ӧ���ɰ�ɫ����������������
��4���������������ȶ����ױ������������ɺ��ɫ������������������ʵ����ϣ���b������������һ���ֿ��������ְ�ɫ������ת��Ϊ����ɫ���ת��Ϊ���ɫ����Ӧ����ʽΪ4Fe(OH)2+O2+2H2O��4Fe(OH)3��


 ����5��2���ϵ�д�
����5��2���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.5 L 1 mol/L FeCl3��Һ��3 L 0.5 mol/L KCl��Һ�е�Cl-����Ŀ֮��
A.1��6B.1��1C.2��1D.3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� ������ʵ��������������ԭ�����͵��� �� ��
A���ϳɰ���ҵ������ѹǿ����߷�Ӧ���ת����
B������ɫ����ˮ���պ���ɫ��dz
C����H2��I2������HI��ɵ�ƽ����ϵ��ѹ����ɫ����
D���ں���Fe��SCN��2���ĺ�ɫ��Һ�м����ۣ����ã���Һ��ɫ��dz����ȥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������Һ�пɴ����������(����)
A. H+��SO42-��K+��OH-
B. H+��Ba2+��NO3-��SO42-
C. K+��Cl-��CO32-��Na+
D. Ca2+��NO3-��Na+��CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���й����ʵĵ���ƽ�ⳣ�����£�
��ѧʽ | CH3COOH | H2CO3 | H2SO3 |
����ƽ�ⳣ�� | K=1.8��10��5 | K1=4.3��10��7 K2=5.6��10��11 | K1=1.5��10��2 K2=1.02��10��7 |
(1)��д��H2SO3�ĵ���ƽ�ⳣ��K1�ı���ʽ��________________��
(2) �����£������Ϊ10mL pH=2�Ĵ�����Һ����������Һ�ֱ������ˮϡ����1000mL��ϡ�ͺ���Һ��pH��ǰ��_____���ߣ����������������=������
(3)һ�������£��������ˮϡ��������Һ��������I���ˮ���V�仯��������ͼ��ʾ����a��b��c������Һ����ĵ���̶��ɴ�СΪ____________________��

(4)��������CH3COO����CO32����HSO3����SO32������Һ�н��H���������ɴ�С�Ĺ�ϵΪ___________��
(5)�����ͬ��c(H��)��ͬ�Ģ�CH3COOH����HCl����H2SO4 ��������Һ�ֱ���ͬŨ�ȵ�NaOH��Һ��ȫ�к�ʱ������NaOH��Һ������ɴ�С������˳����_____(�����)��
(6)��֪��H��(aq) + OH��(aq) == H2O(l) ��H =��57.3 kJ/mol��ʵ����ϡ������ϡNaOH��Һ��Ӧ����1 mol H2Oʱ�ų�57 kJ���ȣ��������Һ�У����������Ȼ�ѧ����ʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ⷨ���Ѱ۲����ķ�Һ��������(Fe2O3)�Ͳ�Ѫ������������������ҵ��������ͼ��ʾ:
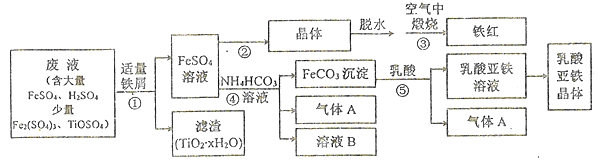
��֪;TiOSO4�ڴ���ˮ�м��������¿���ȫˮ���ΪTiO2��xH2O������
�밴Ҫ��ش���������:
��1������ټ���������м��Ŀ����_________��TiOSO4��ȫˮ��Ļ�ѧ����ʽΪ_________��
��2������ڵ�ϵ�в����У���Ҫ����__________��_________�����£��ٽ�������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����ϴ��Һѡ��ϡ�������ˮ���ŵ���__________��
��3��д���������Ļ�ѧ����ʽ: _________��
��4��ij��ȤС��ѧ������м��ϡ���ᡢNH4HCO3��ҺΪԭ�ϣ�������ͼװ�ã����ò���ܷ�Ӧ���ﵽ�Ʊ�FeCO3��Ŀ�ġ�
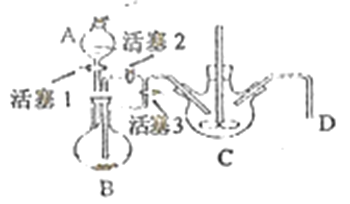
i.NH4HCO3��ҺӦʢ����װ��(����ĸ) _______�С���װ�����漰����Ҫ��Ӧ�����ӷ���ʽ_________��
ii.��ɲ���ܷ�Ӧ�IJ�����__________��
��5���ⶨ����������þ�����FeSO4��7H2O����������:
��ȡag������Ʒ�����100.00mL��Һ��ȡ��25.00mL��Һ���������ữ��0.1000mol/LKMnO4����Һ�ζ�(���ʲ���KMnO4��Һ��Ӧ)��ƽ����Чʵ��ζ�����KMnO4��Һ�����ƽ��ֵΪ20.00mL�������þ�����FeSO4��7H2O����������Ϊ����M(FeSO4��7H2O)=bg/mol���ú�a��b�ı���ʽ��ʾ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����нṹͼ�У������ǰ������Ԫ�ص�ԭ��ʵ��ԭ��ʵ��ԭ�ӳ�ȥ�������Ӻ�ʣ��IJ��֣���С�ڵ����δ�����γɹ��ۼ����������ӣ����ߴ����ۼ���ʾ������ͼ��F2�����ݸ�ͼ��ʾ�Ľṹ�ص㣬�����й�������ȷ���ǣ�������

A. �����ṹͼ�й�����6��Ԫ�� B. �ס��ҡ���Ϊ�Ǽ��Է��ӣ���Ϊ���Է���
C. ���붡���Է������Ϸ�Ӧ�������ӻ����� D. ��CaCl2��Һ��ͨ����а�ɫ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ļ�����������ʵ�飺

��1������X��������________________��
��2������A��___________���ѧʽ����
��3����ҺB�������ӳ�OH- ���__________�������ӷ��ţ�����ҺD�д��ڵĽ�������Ϊ_________�������ӷ��ţ���
��4����������NaOH��Һʱ������Ӧ�����ӷ���ʽΪ��_________������ϡ���ᷢ����Ӧ�����ӷ���ʽΪ��___________________________________________��
��5������ҺD����NaOH��Һ���۲쵽�����İ�ɫ��״����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ����д������ת���Ļ�ѧ����ʽ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڳ�����pH=1��������Һ���й�������
�ٸ���Һ1mLϡ����100mL��pH=3
�������Һ�м���������pH=13������������Һǡ����ȫ�к�
�۸���Һ������������c(H+)��ˮ�������c(H+)֮��ֵΪ1��10��12
�������Һ�м�����������Ũ�ȵİ�ˮ��������ҺpH=7
������ȷ����
A. �٢� B. �٢� C. �ڢ� D. �ۢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com