
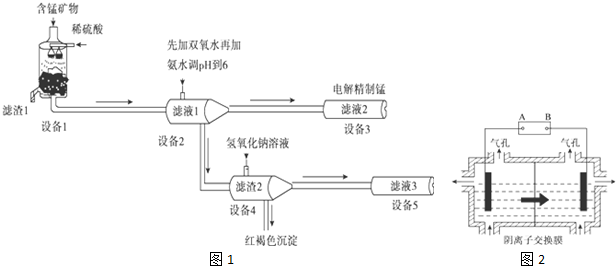
分析 锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等,用硫酸溶解,SiO2不硫酸反应,MnCO3、FeCO3、Al2O3与硫酸反应得到MnSO4、FeSO4、Al2(SO4)3,而滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2,酸性条件下MnO2将Fe2+离子氧化为Fe3+离子,过滤除去二氧化硅等不溶物,滤渣1为SiO2等不溶物.滤液1中加入过氧化氢将Fe2+离子氧化为Fe3+离子,再加入氨水调节溶液pH使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤液2中含有MnSO4、NH4SO4等,滤渣2为Fe(OH)3、Al(OH)3,向滤渣2中加入氢氧化钠,氢氧化铝溶解得到NaAlO2,过滤分离.滤液2电解得到Mn,
(1)滤渣1的主要成分是二氧化硅;
(2)设备1中发生氧化还原反应:二氧化锰在酸性条件下将+2价铁氧化为铁离子,二氧化硫被还原得到Mn2+;
(3)设备2中加足量双氧水将Fe2+离子氧化为Fe3+离子;利用加入铁氰化钾溶液检验Fe2+离子;
(4)Al(OH)3存在电离平衡:Al3++3OH-?Al(OH)3?AlO2-+H++H2O,加入NaOH溶液,H+被中和,平衡正向移动,氢氧化铝被溶解;
(5)①电解装置中箭头表示溶液中阴离子移动的方向,则左室为阴极室,右室为阳极室,A为电源的负极,B为电源的阳极,阳极以稀硫酸为电解液,溶液中氢氧根离子放电生成氧气;
②Mn2+进入阳极区,发生氧化反应生成MnO2,需要有水参与反应,根据电荷守恒可知有氢离子生成.
解答 解:锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等,用硫酸溶解,SiO2不硫酸反应,MnCO3、FeCO3、Al2O3与硫酸反应得到MnSO4、FeSO4、Al2(SO4)3,而滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2,酸性条件下MnO2将Fe2+离子氧化为Fe3+离子,过滤除去二氧化硅等不溶物,滤渣1为SiO2等不溶物.滤液1中加入过氧化氢将Fe2+离子氧化为Fe3+离子,再加入氨水调节溶液pH使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤液2中含有MnSO4、NH4SO4等,滤渣2为Fe(OH)3、Al(OH)3,向滤渣2中加入氢氧化钠,氢氧化铝溶解得到NaAlO2,过滤分离.滤液2电解得到Mn,
(1)根据分析可知,滤渣1的主要成分是SiO2,
故答案为:SiO2;
(2)设备1中发生氧化还原反应:二氧化锰在酸性条件下将+2价铁氧化为铁离子,二氧化硫被还原得到Mn2+,反应离子方程式为:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O 或2FeCO3+MnO2+8H+=2Fe3++Mn2++CO2↑+4H2O,
故答案为:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O 或2FeCO3+MnO2+8H+=2Fe3++Mn2++CO2↑+4H2O;
(3)设备2中加足量双氧水将Fe2+离子氧化为Fe3+离子,便于调节pH时转化为沉淀除去,检验滤液2中是否存在Fe2+的方案为:取滤液2,加入铁氰化钾溶液,如果有蓝色沉淀产生,则有Fe2+,否则没有Fe2+,
故答案为:将Fe2+完全氧化为Fe3+;取滤液2,加入铁氰化钾溶液,如果有蓝色沉淀产生,则有Fe2+,否则没有Fe2+;
(4)根据分析可知,滤渣2中存在Al(OH)3,存在电离平衡:Al3++3OH-?Al(OH)3?AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,导致Al(OH)3不断溶解,
故答案为:滤渣2中存在Al(OH)3,存在电离平衡:Al3++3OH-?Al(OH)3?AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解;
(5)①电解装置中箭头表示溶液中阴离子移动的方向,则左室为阴极室,右室为阳极室,A为电源的负极,B为电源的阳极,阳极以稀硫酸为电解液,溶液中氢氧根离子放电生成氧气,电极反应为:4OH--4e-=2H2O+O2↑,
故答案为:负极;4OH--4e-=2H2O+O2↑;
②Mn2+进入阳极区,发生氧化反应生成MnO2,需要有水参与反应,根据电荷守恒可知有氢离子生成,该副反应的电极反应式:Mn2++2H2O-2e-=MnO2+4H+,
故答案为:Mn2++2H2O-2e-=MnO2+4H+.
点评 本题通过锰的制备工艺流程,考查了制备方案的设计、阅读题目获取信息能力,题目难度中等,涉及物质的分离提纯、化学平衡移动、电解原理等知识,根据制备流程明确目的、实验原理为解答关键,试题综合性较大,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.


科目:高中化学 来源: 题型:选择题
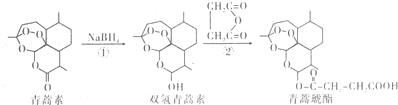
| A. | 青蒿素分子中所有碳原子在同一平面内 | |
| B. | 反应①属于还原反应,反应②理论上原子利用率可达100% | |
| C. | 双氢青蒿素属于芳香化合物 | |
| D. | 青蒿琥酯可以发生水解、酯化以及加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
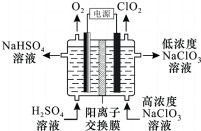 ClO2是高效杀菌消毒剂.用惰性电极电解NaC1O3溶液制备高纯C1O2的原理如下图所示.下列说法正确的是( )
ClO2是高效杀菌消毒剂.用惰性电极电解NaC1O3溶液制备高纯C1O2的原理如下图所示.下列说法正确的是( )| A. | 电解过程中,Na+向阴极区移动 | |
| B. | 电解产生的O2和ClO2在相同条件下的体积比为1:1 | |
| C. | 阴极的电极反应式是ClO3-+H2O+e-=ClO2↑+2OH- | |
| D. | 电解总反应的化学方程式是4NaClO3+4H2SO4$\frac{\underline{\;电解\;}}{\;}$O2↑+4ClO2↑+4NaHSO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物对应水化物的碱性大小顺序一定是:X>Y | |
| B. | 离子半径和原子半径由大到小的顺序均为X>Y>Z>W | |
| C. | 氢化物的稳定性是Z>W;氢化物的沸点是Z<W | |
| D. | 还原性Zm->W(m+1)-,氧化性Xn+>Y(n+1)+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
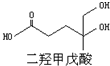 我国科学家屠呦呦因为发现青蒿素而获得2015年诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )
我国科学家屠呦呦因为发现青蒿素而获得2015年诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )| A. | 二羟甲戊酸的分子式为C6H10O4 | |
| B. | 能发生加成反应,不能发生取代反应 | |
| C. | 在铜的催化下与氧气反应的产物能发生银镜反应 | |
| D. | 1mol该有机物可以与足量金属钠反应产生33.6L H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
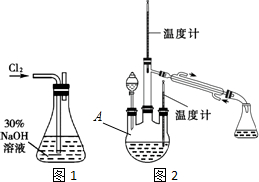
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
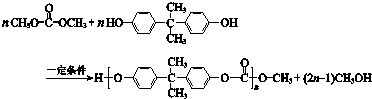
| A. | PC含有酯基 | |
| B. | 合成PC的反应为缩聚反应 | |
| C. | 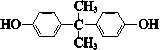 与 与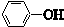 互为同系物 互为同系物 | |
| D. | 1 mol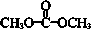 最多能与2 mol NaOH完全反应 最多能与2 mol NaOH完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (×lO-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO) (×lO-3mol•L-1) | 2.70 | 2.15 | 1.95 | 1.85 | 1.80 | 1.80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com