
| A. | 工业上可角电解法制备Mg:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+C12↑ | |
| B. | 用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+═2Cr3++Fe3++7H2O | |
| C. | 用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq) | |
| D. | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2═2HClO+CaCO3↓ |
分析 A.电解熔融氯化镁生成金属Mg和氯气;
B.离子方程式两边的总电荷不相等,违反了电荷守恒;
C.碳酸钙比硫酸钙更难溶,实现了沉淀的转化;
D.次氯酸钙与少量二氧化碳反应生成次氯酸和碳酸钙沉淀.
解答 解:A.工业上可角电解法制备Mg,反应的化学方程式为:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+C12↑,故A正确;
B.用FeSO4除去酸性废水中的Cr2O72-,二者发生氧化还原反应,正确的离子方程式为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,故B错误;
C.用CaSO4治理盐碱地,碳酸钠转化成碳酸钙沉淀,反应的化学方程式为:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq),故C正确;
D.向Ca(ClO)2溶液中通入少量CO2,反应生成次氯酸和碳酸钙沉淀,反应的离子方程式为:Ca2++2ClO-+H2O+CO2═2HClO+CaCO3↓,故D正确;
故选B.
点评 本题考查化学方程式、离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子方程式、化学方程式正误判断常用方法:如:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等;试题培养了学生的灵活应用能力.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 40% | C. | 50% | D. | 60% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子电子层数增大 | |
| B. | 元素原子最外层电子数呈现周期性变化 | |
| C. | 元素的化合价呈现周期性变化 | |
| D. | 核电荷数依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气是一种黄绿色的有毒气体 | |
| B. | 灼热的铜丝在氯气中燃烧,生成棕黄色的烟 | |
| C. | 可以用排饱和食盐水法收集氯气 | |
| D. | 氯水、液氯是同一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cu2+、Cl-、SO42- | B. | H+、Na+、Fe2+、NO3- | ||
| C. | K+、Mg2+、Cl-、SO42- | D. | K+、Fe3+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
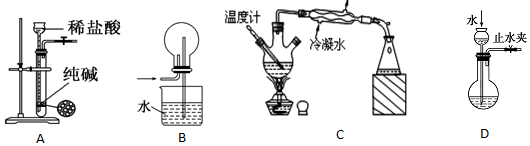
| A. | 用图A装置制取少量CO2气体 | |
| B. | 多余的NH3可用图B装置吸收 | |
| C. | 装置C可分离沸点不同且互溶的液体混合物 | |
| D. | 图D可检查装置的气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5(b-2a)mol/L | B. | 5(b-2a)mol/L | C. | 0.5(b-a)mol/L | D. | 10(b-2a)mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被氧化的Cu2O为1.44 g | |
| B. | 做氧化剂的硝酸为0.14 mol | |
| C. | 至少需0.5 moI/L硝酸140 mL与Cu2O反应 | |
| D. | 转移的电子总数为0.06 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
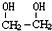 )是一种重要的化工原料,
)是一种重要的化工原料, (g)△H=a kJ/mol
(g)△H=a kJ/mol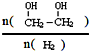 增大的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来(写两条)
增大的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来(写两条)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com