
【题目】元素铬![]() 在溶液中主要以
在溶液中主要以![]() 蓝紫色
蓝紫色![]() 、
、![]() 绿色
绿色![]() 、
、![]() 橙红色
橙红色![]() 、
、![]() 黄色
黄色![]() 等形式存在,
等形式存在,![]() 为难溶于水的灰蓝色固体,回答下列问题:
为难溶于水的灰蓝色固体,回答下列问题:
(1)![]() 与
与![]() 的化学性质相似,在
的化学性质相似,在![]() 溶液中逐滴加入NaOH溶液直至过量,可察到的现象是 ______________________________________________ .
溶液中逐滴加入NaOH溶液直至过量,可察到的现象是 ______________________________________________ .
(2)![]() 和
和![]() 在溶液中可相互转化
在溶液中可相互转化![]() 室温下,初始浓度为
室温下,初始浓度为![]() 的
的![]() 溶液中
溶液中![]() 随
随![]() 的变化如图所示.
的变化如图所示.
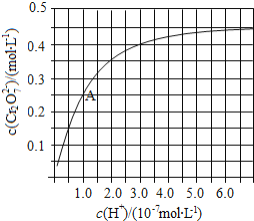
![]() 用离子方程式表示
用离子方程式表示![]() 溶液中的转化反应______________________________ .
溶液中的转化反应______________________________ .
![]() 由图可知,溶液酸性增大,
由图可知,溶液酸性增大,![]() 的平衡转化率__________________
的平衡转化率__________________ ![]() 填“增大“减 小”或“不变”
填“增大“减 小”或“不变”![]() 根据A点数据,计算出该转化反应的平衡常数为 _______________ .
根据A点数据,计算出该转化反应的平衡常数为 _______________ .
![]() 升高温度,溶液中
升高温度,溶液中![]() 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的![]() ______
______ ![]() 填“大于”“小于”或“等于”
填“大于”“小于”或“等于”![]() .
.
(3)在化学分析中采用![]() 为指示剂,以
为指示剂,以![]() 标准溶液滴定溶液中的
标准溶液滴定溶液中的![]() ,利用
,利用![]() 与
与![]() 生成砖红色沉淀,指示到达滴定终点
生成砖红色沉淀,指示到达滴定终点![]() 当溶液中
当溶液中![]() 恰好完全沉淀
恰好完全沉淀![]() 浓度等于
浓度等于![]() 时,溶液中
时,溶液中![]() 为 ______
为 ______ ![]() ,此时溶液中
,此时溶液中![]() 等于 ______
等于 ______ ![]() 已知
已知![]() 、AgCl的
、AgCl的![]() 分别为
分别为![]() 和
和![]()
(4)![]() 价铬的化合物毒性较大,常用
价铬的化合物毒性较大,常用![]() 将废液中的
将废液中的![]() 还原成
还原成![]() ,反应的离子方程式为 _________________________________________________ .
,反应的离子方程式为 _________________________________________________ .
【答案】 蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液 ![]() 增大
增大 ![]() 小于
小于 ![]()
![]() 5
5![]()
【解析】![]() 与
与![]() 的化学性质相似,则
的化学性质相似,则![]() 具有两性。由图可知,
具有两性。由图可知,![]() 和
和![]() 在溶液中相互转化的离子方程式为
在溶液中相互转化的离子方程式为![]() 。溶液酸性增大,平衡向正反应方向移动,则
。溶液酸性增大,平衡向正反应方向移动,则![]() 的平衡转化率增大
的平衡转化率增大![]() A点坐标为(1.0,0.25),此时c(
A点坐标为(1.0,0.25),此时c(![]() )=0.5
)=0.5![]() ,则该转化反应的平衡常数为
,则该转化反应的平衡常数为![]() .升高温度,溶液中
.升高温度,溶液中![]() 的平衡转化率减小,说明该平衡向逆反应方向移动,则该反应为放热反应,
的平衡转化率减小,说明该平衡向逆反应方向移动,则该反应为放热反应,![]() 小于
小于![]() .
.
(1)![]() 与
与![]() 的化学性质相似,则
的化学性质相似,则![]() 具有两性,故在
具有两性,故在![]() 溶液中逐滴加入NaOH溶液直至过量,先生成沉淀
溶液中逐滴加入NaOH溶液直至过量,先生成沉淀![]() ,后沉淀又逐渐溶解,可察到的现象是:蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液.
,后沉淀又逐渐溶解,可察到的现象是:蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液.
(2)![]() 由图可知,
由图可知,![]() 和
和![]() 在溶液中相互转化的离子方程式为
在溶液中相互转化的离子方程式为![]() .
.
![]() 由图可知,溶液酸性增大,平衡向正反应方向移动,则
由图可知,溶液酸性增大,平衡向正反应方向移动,则![]() 的平衡转化率增大
的平衡转化率增大![]() A点坐标为(1.0,0.25),此时c(
A点坐标为(1.0,0.25),此时c(![]() )=0.5
)=0.5![]() ,则该转化反应的平衡常数为
,则该转化反应的平衡常数为![]() .
.
![]() 升高温度,溶液中
升高温度,溶液中![]() 的平衡转化率减小,说明该平衡向逆反应方向移动,则该反应为放热反应,
的平衡转化率减小,说明该平衡向逆反应方向移动,则该反应为放热反应,![]() 小于
小于![]() .
.
(3)在化学分析中采用![]() 为指示剂,以
为指示剂,以![]() 标准溶液滴定溶液中的
标准溶液滴定溶液中的![]() ,利用
,利用![]() 与
与![]() 生成砖红色沉淀,指示到达滴定终点
生成砖红色沉淀,指示到达滴定终点![]() 当溶液中
当溶液中![]() 恰好完全沉淀
恰好完全沉淀![]() 浓度等于
浓度等于![]() 时,溶液中
时,溶液中![]() 为
为![]()
![]() ,此时溶液中
,此时溶液中![]() 等于
等于![]()
![]()
![]()
(4)![]() 价铬的化合物毒性较大,常用
价铬的化合物毒性较大,常用![]() 将废液中的
将废液中的![]() 还原成
还原成![]() ,反应的离子方程式为
,反应的离子方程式为 ![]()


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知
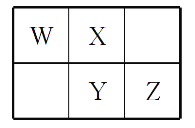
A. X、Y、Z中最简单氢化物稳定性最弱的是Y
B. Z元素氧化物对应水化物的酸性一定强于Y
C. X元素形成的单核阴离子还原性大于Y
D. Z元素单质在化学反应中只表现氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:![]() 已知
已知![]()
容器 | 甲 | 乙 | 丙 |
反应物的投入量 |
|
|
|
|
|
|
|
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
体系的压强 |
|
|
|
反应物的转化率 |
|
|
|
下列说法正确的是![]()
![]()
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙酮(CH3COCH3)在某溶剂里,在催化剂作用下发生反应:2CH3COCH3(aq) ![]() CH3COCH2COH(CH3)2(aq);取相同浓度的CH3COCH3,分别在40℃和60℃时,测得其转化率
CH3COCH2COH(CH3)2(aq);取相同浓度的CH3COCH3,分别在40℃和60℃时,测得其转化率![]() 随时间变化的关系曲线(
随时间变化的关系曲线(![]() )如图所示。
)如图所示。
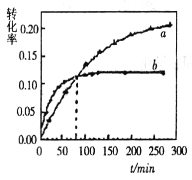
下列说法正确的是
A.b代表40℃时CH3COCH3的a—t曲线
B.升高温度可缩短该反应达平衡的时间并能提高平衡转化率
C.增大压强可缩短该反应达平衡的时间并能提高平衡转化率
D.上述反应的逆反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】14C是一种放射性同位素,在高层大气中由宇宙射线产生的中子或核爆炸产生的中子轰击14N可使它转变为14C。下列说法正确的是
A.14N核外电子数与中子数相同B.14C的核外电子数为8
C.14C和14N互为同位素D.14C和12C的所有性质都相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X+Y→M+N反应中的能量变化过程如图,则下列推断一定正确的是
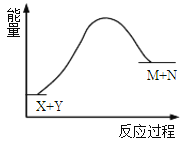
A. X的能量低于M的能量 B. Y的能量低于N的能量
C. X和Y总能量低于M和N总能量 D. 该反应是吸热反应,反应条件是加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2Fe04)是一种理想的绿色高效水处理剂。某学习小组用如图所示装置(夹持仪器已略去)制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备K2Fe04。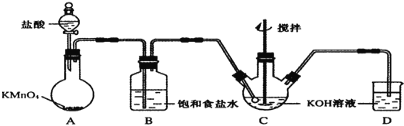
查阅资料知K2FeO4的部分性质如下:①可溶于水、微溶于浓KOH溶液;
②在0-5℃、强碱性溶液中比较稳定;
③在Fe3+和Fe(OH)3催化作用下发生分解;
④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。
请回答下列问题:
(1)仪器C和D中都盛有KOH溶液,其中C中KOH溶液的用途是_____。
(2)Cl2与KOH的浓溶液在较高温度下反应生成KClO3。为保证反应生成KClO,需要将反应温度控制在0-5℃,在不改变KOH溶液浓度的前提下,实验中可以采取的措施是_____。
(3)在搅拌条件下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中即可制取K2Fe04,写出该反应的化学方程式_____;该操作不能将KClO饱和溶液滴加到Fe(NO3)3饱和溶液中,其原因是_____。
(4)制得的粗产品中含有Fe(OH)3、KCl等杂质。一种提纯方案为:将一定量的K2Fe04粗产品溶于冷的3mol/LKOH溶液中,用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置,再用砂芯漏斗过滤,晶体用适量乙醇洗涤2-3次后,在真空干燥箱中干燥。
①第一次和第二次过滤得到的固体分别对应的是(填化学式)_____、_____。
②晶体用乙醇洗涤的原因是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com