
【题目】反应4A(g)+3B(g)=2C(g)+D(g),经2min,B的浓度减少0.6mol·L-1。对此反应速率的表示,正确的是
①用A表示的反应速率是0.4 mol·L-1·min-1 ②分别用B、C、D表示的反应速率其比值为3∶ 2∶1 ③在2 min末的反应速率,用B表示是0.3mol·L-1·min-1④在这2 min内用B表示的反应速率的值是逐渐减小的,用C表示的反应速率的值是逐渐增大的( )
A. ①② B. ③ C. ① D. ②④
【答案】A
【解析】①2min内B的浓度减少0.6mol·L-1,用B表示的平均速率为:v(B)=0.6mol·L-1÷2min=0.3mol·L-1·min-1,同一反应用不同物质表示的速率之比等于化学计量数之比,所以用A表示的反应速率是v(A)=![]() ×0.3mol·L-1·min-1=0.4 mol·L-1·min-1,故①正确;②同一反应用不同物质表示的速率之比等于化学计量数之比,所以用B、C、D表示的反应速率其比值为3:2:1,故②正确;③由上面分析知,2min内用B表示的平均速率为0.3mol·L-1·min-1,在2 min末的反应速率应为瞬时速率,用B表示不是0.3mol·L-1·min-1,故③错误;④随反应进行反应物的浓度降低,反应速率减慢,所以2min内用B和C表示的反应速率都是逐渐减小的,故④错误。综上①②正确,选A。
×0.3mol·L-1·min-1=0.4 mol·L-1·min-1,故①正确;②同一反应用不同物质表示的速率之比等于化学计量数之比,所以用B、C、D表示的反应速率其比值为3:2:1,故②正确;③由上面分析知,2min内用B表示的平均速率为0.3mol·L-1·min-1,在2 min末的反应速率应为瞬时速率,用B表示不是0.3mol·L-1·min-1,故③错误;④随反应进行反应物的浓度降低,反应速率减慢,所以2min内用B和C表示的反应速率都是逐渐减小的,故④错误。综上①②正确,选A。


科目:高中化学 来源: 题型:
【题目】实验室以软锰矿(主要成分为MnO2,还有少量FeO、Fe2O3、MgO和Al2O3杂质)为原料制备高锰酸钾的流程如下图:

(1) “酸浸”需要加热的目的是__________,此过程中发生反应的离子方程式是______________。(任写一条)
(2) “熔融”过程中,MnO2被KC1O3氧化成K2MnO4。
①该反应的化学方程式为_____________________。
②加入KC1O3应过量的原因除了提高MnO2利用率,还有_________________.
③将适量KClO3和KOH混合均匀后在坩埚内高温反应,应选用坩埚为__________。(选填序号)
a.石英坩埚 b.铁坩埚 c.氧化铝坩埚
(3)己知:①MnO42-只存在于强碱环境(pH>13.5)中,当pH降低时,MnO42-会歧化为MnO4-和MnO2;②饱和碳酸钾溶液的pH约为12.3,饱和碳酸氢钾溶液的pH约为8.8;③相关物质的溶解度曲线如下图。

请补充完整由浸取液制备KMnO4晶体的实验方案:向浸取液中缓缓通入CO2,_____________,低温供干得KMnO4晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铈(58Ce)常用于制作稀土磁性材料,可应用于制造玻璃、打火石、陶瓷和合金等.已知:Ce4++Fe2+═Ce3++Fe3+ . 下列说法正确的是( )
A.Ce元素位于元素周期表第六周期第IIIB族
B.![]() Ce、
Ce、 ![]() Ce是同素异形体
Ce是同素异形体
C.铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+=Ce4++2H2
D.铈的原子核外有58个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠及制备金属钼的主要流程图如图所示:

(1) Na2MoO4·2H2O中钼元素的化合价是_________。结晶得到的钼酸钠晶体是粗产品,要得到纯净的钼酸钠晶体,下一步需要进行的操作是_________________(填名称)。
(2)灼烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2→MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);若反应中生成36.0 gMoO3,反应中,转移电子的数目为____________。
(3)尾气中含有SO2需要处理,下列不能用作吸收剂的是_______________(填序号)。
a.Ca(OH)2 b. HNO3 c. Na2CO3
(4)加入Na2CO3溶液时发生反应的化学方程式为_____________________。
(5)利用铝热反应也可回收金属钼,写出MoO3发生铝热反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中存在XO-,且X为短周期元素,则一定能在该溶液中大量共存的离子组是( )。
A. Na+、H+、SO42-、I-B. Na+、Ca2+、CO32-、Al3+
C. Na+、K+、Fe2+、H+D. K+、SO42-、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s) ![]() yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
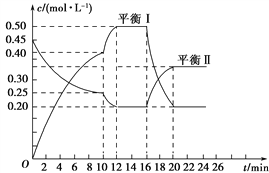
(1)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=______________________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是______________________;第16min引起曲线变化的反应条件可能是________________________。
①减压 ②增大A的浓度 ③增大C的量 ④升温⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向2L体积固定的密闭容器中加入1molHI,2HIH2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确的是( )
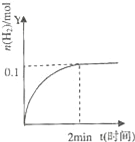
A. 该温度下,反应的平衡常数是![]()
B. 0~2min内的HI的平均反应速率为0.05molL﹣1min﹣1
C. 恒压下向该体系中加入N2,平衡不移动,反应速率不变
D. 升高温度,平衡向正反应方向移动,只有正反应速率加快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com