
 空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.分析 (1)设参加反应的SO2为nmol
SO2(g)+NO2(g)=SO3(g)+NO(g)
反应前(mol) 1 1 0 0
反应了(mol) n n n n
5min末(mol) 1-n 1-n n n
可以此计算相关量;
(2)①化学平衡图象分析方法,平衡图象题主要注意三点一趋势,三点是:图象的起点、拐点、终点,一趋势是看曲线的变化趋势.当然要看好横、纵坐标的向量.
②对于一个给定的化学反应,化学平衡常数的影响因素只有温度;
③碱性条件下,正极发生还原反应生成OH-.
解答 解(1)设参加反应的SO2为nmol
SO2(g)+NO2(g)=SO3(g)+NO(g)
反应前(mol) 1 1 0 0
反应了(mol) n n n n
5min末(mol) 1-n 1-n n n
$\frac{n}{1-n}$=$\frac{3}{1}$可求得:n=$\frac{3}{4}$=0.75
υ(SO2)=$\frac{0.75}{2×5}$=0.075mol/(L•min)
因其体积是2L,求出各自的浓度代入可求K
K=$\frac{0.375×0.375}{0.125×0.125}$=9
故答案为:0.075mol/(L•min);9;
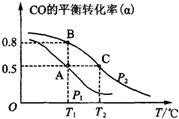
(2)①从图上可见,在P2时,随温度的升高CO的转化率越来越低,可见,升温时平衡向逆向移动,据勒夏特列原理,正反应放热.
故答案为:放热;
②化学平衡常数只受温度的影响,该反应放热,温度越高平衡逆向移动,K值减小.增大压强,平衡正向移动,CO的转化率增大,可知PA 小于PB,
故答案为:KA=KB>KC;小于;
③燃料电池的正极,是氧气反应,在碱性条件下有水参与生成氢氧根.O2+2H2O+4e-=4OH-
A点CO的平衡转化率50%,参加反应的CO为:10mol×50%=5mol
从CO(g)+2H2(g)=CH3OH(g)分析,生成CH3OH也为5mol,CH3OH燃烧生成二氧化碳和水,只有C的价态从-2变为+4,H、O价态没变,所以1molCH3OH燃烧转移6mol电子,故5molCH3OH反应转移电子为:5×6=30.
故答案为:O2+2H2O+4e-=4 OH-;30.
点评 本题考查化学平衡的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握化学平衡的计算方法以及图象的判断,把握电极方程式的书写,难度不大.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 加入催化剂,有利于合成氨的反应 | |
| C. | 将混合气体中的氨液化,有利于合成氨的反应 | |
| D. | 工业生产硫酸的过程中,使用过量的空气以提高二氧化硫的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
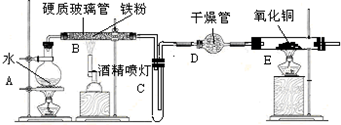
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
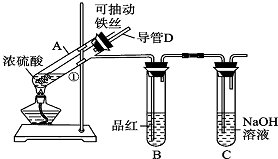
| 实验步骤 | 预期现象 |
| 步骤一:用胶头滴管取出A试管中的溶液,用水稀释后,并分装在试管Ⅰ、Ⅱ中备用 | |
| 步骤二:检验Fe3+,往试管Ⅰ中,滴入几滴KSCN溶液 | 溶液呈现血红色 |
| 步骤三:检验Fe2+,往试管Ⅱ中,滴入少量KMnO4溶液(或先滴入几滴稀硫酸) | 紫红色变浅或消褪 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4 (g)?2NO2 (g)△H>0,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4 (g)?2NO2 (g)△H>0,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
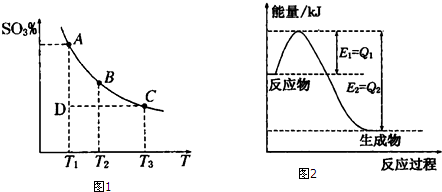
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒容容器内混合气体的密度不再变化 | |
| B. | AB3的生成速率与B2的生成速率之比为2:3 | |
| C. | 恒压容器内混合气体的总物质的量不再变化 | |
| D. | 单位时间内断裂a mol A≡A键,同时断裂6a mol A-B键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com