
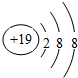
分析 A、B、C、D 四种元素的核电荷数依次增大,A原子的L层电子数与K、M层电子数之和相等,则M层电子数=8-2=6,故A为S元素;D原子的K、L层电子数之和等于电子总数的一半,则L层已经排满电子,故核外电子数=2×(2+8)=20,故D为Ca元素,四元素的离子的电子层数相同且最外层电子数均为8,结合原子序数,可推知,B为Cl、C为K,据此解答.
解答 解:A、B、C、D 四种元素的核电荷数依次增大,A原子的L层电子数与K、M层电子数之和相等,则M层电子数=8-2=6,故A为S元素;D原子的K、L层电子数之和等于电子总数的一半,则L层已经排满电子,故核外电子数=2×(2+8)=20,故D为Ca元素,四元素的离子的电子层数相同且最外层电子数均为8,结合原子序数,可推知,B为Cl、C为K.
(1)A为S元素,在周期表中的位置为第三周期第VIA族,故答案为:三、VIA;
(2)同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Ca>S,故答案为:Ca;S;
(3)C元素的离子为K+,离子结构示意图: ,故答案为:
,故答案为: ;
;
(4)B元素的最高价氧化物对应水化物的化学式是:HClO4,金属性K>Ca,故最高价氧化物对应水化物的碱性:KOH>Ca(OH)2,故答案为:HClO4;KOH>Ca(OH)2;
(5)非金属性Cl>S,故气态氢化物的稳定性:HCl>H2S,故答案为:HCl>H2S;
(6)A、C两种元素最高价氧化物的水化物分别为硫酸、KOH,二者反应的离子方程式为:H++OH-=H2O,故答案为:H++OH-=H2O.
点评 本题考查结构性质位置关系应用,充分根据核外电子排布推断A、D,注意理解掌握元素周期律,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比是2:1 | |
| B. | 当生成22.4LSO2气体时,转移的电子数目是2NA | |
| C. | 该反应写成离子式是Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu+SO2↑+2H2O | |
| D. | 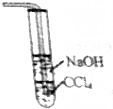 制备SO2装置尾气可用如图处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
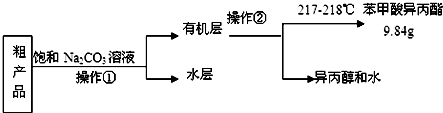
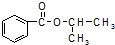 ),已知有关物质的沸点如表:
),已知有关物质的沸点如表:| 物质 | 异丙醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 82.4 | 249 | 218 |
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质有还原性 | B. | 硒元素在化合物中可显-2价 | ||
| C. | 硒化氢水溶液显弱碱性 | D. | 最高价氧化物的水化物显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
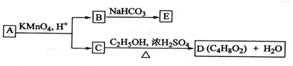
| A. | B的结构简式为HOOC-CH2-COOH | |
| B. | C与乙醇发生了酯化反应 | |
| C. | A的结构简式是CH3-CH(OH)-CH=CH-CH3 | |
| D. | E的分子式为C3H2O4Na2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的比例模型: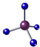 | B. | O2与O22-互为同分异构体 | ||
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同素异形体 | D. | S2-的结构示意图: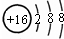 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2和Na2O2 | B. | NaOH和CCl4 | C. | CO2和MgCl2 | D. | NaOH和NaClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com