
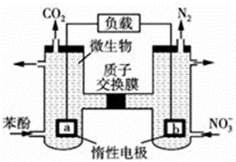
| A. | b电极反应式为2NO3-+10e-+12H+=N2↑+6H2O | |
| B. | a电极发生还原反应 | |
| C. | H+由右室通过质子交换膜进入左室 | |
| D. | 电池工作时,电流由a电极沿导线流向b电极 |
分析 A、b极上N元素的化合价降低,所以b是正极发生还原反应;
B、b极上N元素的化合价降低,所以b是正极发生还原反应,a是负极,发生氧化反应;
C、原电池中阳离子从负极移向正极;
D、原电池中电流从正极流向负极,据此回答.
解答 解:A、b极上N元素的化合价降低,b是正极,发生还原反应,电极反应式为:2NO3-+10e-+12H+═N2↑+6H2O,故A正确;
B、b极上N元素的化合价降低,所以b是正极发生还原反应,故B错误;
C、原电池中阳离子从负极移向正极,即H+由左室通过质子交换膜进入右室,故C错误;
D、原电池中电流从正极流向负极,电流由B电极沿导线流向A电极,故D错误.
故选A.
点评 本题考查化学电源新型电池,为高频考点,所有燃料电池中负极上都是燃料失电子、正极上都是氧化剂得电子,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,为学习难点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
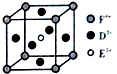 A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):
A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示): .
. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| B. | 28克由C3H6和C4H8组成的混合气体中含共用电子对数目为6NA个 | |
| C. | 0.1mol氧气作为氧化剂得到电子的数目一定为0.4NA | |
| D. | 常温下,0.1mol•L-1的碳酸钠溶液中含有的阴离子数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
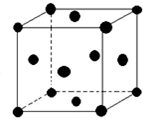 现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.| A | 基态原子最外层电子数是次外层的三倍 |
| B | 基态原子核外有13种不同运动状态的电子 |
| C | 与B同一周期,原子中未成对电子数是同周期中最多的 |
| D | D2-的核外电子排布与氩原子相同 |
| E | 是ds区原子序数最小的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀 HNO3反应制备 H2 | B. | 加热分解 NH4Cl 固体制 NH3 | ||
| C. | 大理石与稀 H2SO4反应制备 CO2 | D. | 亚硫酸钠与浓 H2SO4反应制备 SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
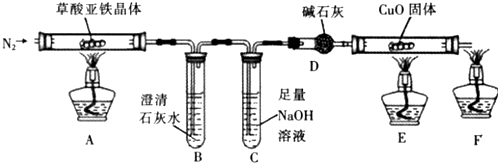
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com