
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
分析 (1)图表中0~50s内氨气的浓度变化为0.24mol,计算氨气的反应速率,速率之比等于化学方程式计量数之比计算得到氮气的反应速率;
(2)250s时,氨气生成的物质的量为0.40mol,则反应的氢气物质的量=0.6mol,转化率=$\frac{消耗量}{起始量}$×100%;
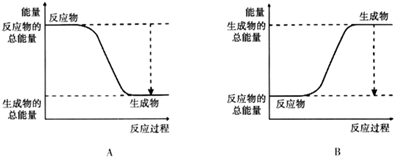
(3)反应焓变△H=反应物总键能-生成物总键能;依据焓变判断反应图象变化;
(4)升高温度、中等压强、增大浓度、加入催化剂、增加接触面积等措施都可以加快反应速率;
(5)氢气和氮气合成氨是可逆反应一定条件下达到平衡状态,为动态平衡,两种反应物增加一种会提高另一种的转化率,催化剂改变反应速率不改变化学平衡.
解答 解:(1)图表中0~50s内氨气的浓度变化为0.24mol,计算氨气的反应速率v(NH3)=$\frac{\frac{0.24mol}{2.0L}}{50s}$=0.0024mol/(L•s),v(NH3):v(N2)=2:1,v(N2)=$\frac{0.0024mol/(L•s)}{2}$=1.2×10-3mol/(L•s ),
故答案为:1.2×10-3mol/(L•s );
(2)250s时,氨气生成的物质的量为0.40mol,则反应的氢气物质的量=0.6mol,转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.6mol}{2.0mol}$×100%=30%,
故答案为:30%;
(3)已知N≡N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,N2(g)+3H2(g)?2NH3(g),生成1molNH3反应过程中能量变化=$\frac{1}{2}$×946KJ/moL+$\frac{3}{2}$×436KJ/mol-3×391kJ/mol=-92KJ/mol,则生成1molNH3过程中的热量变化位92KJ,反应为放热反应,反应物能量高于生成物的能量,反应为放热反应,正确表示该反应中能量变化的是选A,
故答案为:92;A;
(4)a.降低温度,反应速率减小,故a错误;
b.增大压强,反应速率增大,故b正确;
c.恒容时充入He气,总压增大,分压不变,平衡不变,反应速率不变,故c错误;
d.恒压时充入He气,体积增大,压强减小,反应速率减小,故d错误;
e.及时分离NH3 反应正向进行,难度减小反应速率减小,故e错误;
故答案为:b;
(5)a.使用催化剂是为了加快反应速率,缩短了反应达到平衡的时间,提高了生产效率,故a正确;
b.上述条件下,反应为可逆反应,N2不可能100%转化为NH3 ,故b正确;
c.为了提高N2的转化率,应适当提高H2的浓度,提高氮气的转化率,氢气转化率减小,故c正确;
d.250~350s生成物浓度保持不变,反应达到平衡状态,反应仍然进行.只是正逆反应速率相同,故d错误;
故答案为:d.
点评 本题考查了化学反应速率、化学平衡的影响因素分析判断、化学平衡移动原理的应用等知识,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 三个反应均为放热反应,故不需要加热就能进行 | |
| B. | CO(g)+2H2(g)═CH3OH(g);△H>-90.5 kJ/mol | |
| C. | 甲醇的燃烧热为764 kJ/mol | |
| D. | 若CO的燃烧热为282.5 kJ/mol,则H2的燃烧热为286 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
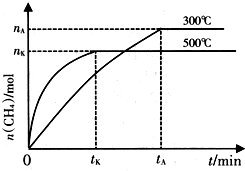 NH3和CO2是两种重要的化工原料.
NH3和CO2是两种重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g)△H<0,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如图所示.
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g)△H<0,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO.反应的热化学方程式如下:
催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO.反应的热化学方程式如下:| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 应量取盐酸体积/ml | 应选用容量瓶的规格/ml | 除容量瓶外还需要的其它仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com